
| A. | Na2CO3 | B. | NaCl | C. | NH4Cl | D. | CH3COONa |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝片能放出氢气的溶液:Na+、CO32-、NO3-、NH4+ | |
| B. | 滴入酚酞显红色的溶液:CO32-、Na+、AlO2-、NO3- | |
| C. | 能使蓝色石蕊试纸变红的溶液:Na+、Cl-、S2-、ClO- | |
| D. | 滴入甲基橙显红色的溶液:MnO4-、K+、SO42-、CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
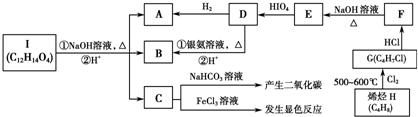
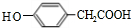 ,E
,E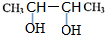 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.4 mol/L | D. | 0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
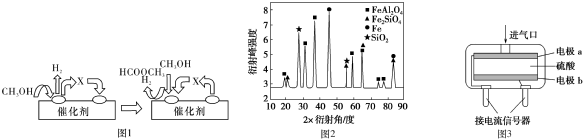
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL | B. | 200mL | C. | 250mL | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com