
- 3 |
- 3 |
- 3 |
- 3 |
- 3 |
+ 4 |
+ 4 |
- 3 |
+ 4 |
- 3 |
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
- 3 |
- 3 |
- 3 |
- 3 |

- 3 |
- 3 |
- 3 |
- 3 |
- 3 |
- 3 |
- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | - 3 |
| O | - 3 |
| O | - 3 |
| O | - 3 |
| O | - 3 |
| O | - 2 |
查看答案和解析>>
科目:高中化学 来源:湖南省期末题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
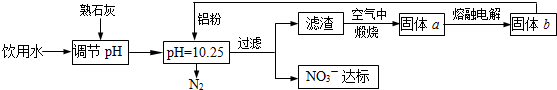
(1)饮用水中的NO![]() 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO![]() 的浓度,可以在碱性条件下用铝粉将NO
的浓度,可以在碱性条件下用铝粉将NO![]() 还原为N2,其化学方程式为:
还原为N2,其化学方程式为:
10Al+2NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。请回答下列问题:
①上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子。
②用“单线桥法”表示反应中电子转移的方向和数目:
10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com