
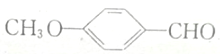
 的同分异构体,符合下列条件,写出H的结构简式:
的同分异构体,符合下列条件,写出H的结构简式: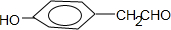 .
.科目:高中化学 来源: 题型:解答题
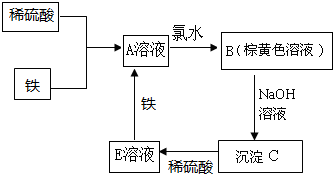 下列物质转化关系如图所示,反应过程中部分产物可能已略去请回答以下问题:
下列物质转化关系如图所示,反应过程中部分产物可能已略去请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 为 0.6mol/L、N2 为 0.2mol/L | B. | NH3为 0.25mol/L | ||
| C. | N2、NH3 均为 0.15mol/L | D. | NH3为 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述不正确的是( )
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述不正确的是( )| A. | H+从负极区通过交换膜移向正极区 | |
| B. | 正极的电极反应式为:O2+H2O+4e-═4OH- | |
| C. | 图中a、b、c、d物质分别是CO2、CH2OH、H2O | |
| D. | 用该燃料电池电解饱和食盐水,产生1.5mol氯气,需要消耗甲醇16克 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
| B | 由油脂得到甘油;由卤代烃制醇 | 均发生了水解反应 |
| C | Cl2+2Br?→2Cl?+Br2;Zn+Cu2+→Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O→4NaOH+O2↑; 2F2+2H2O→4HF+O2 | 均为水作还原剂的氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com