
����Ŀ��������һ����Ҫ�Ļ�ѧ���ʣ����������������ж�����;��
��1���Ӻ�ˮ�л��ʳ�εķ�����Ϊ___________��NaCl�ĵ���ʽ��________��
��2��ʵ���ҵ�ⱥ��ʳ��ˮ��װ������ͼ��ʾ�������ж���ȷ����_________��ѡ���ţ���

A���缫aΪ����
B���缫b�Ϸ����˻�ԭ��Ӧ
C������������Һ���
D��������������ɫ����
��3����ҵ���õ�ⱥ��ʳ��ˮ�ķ�����ȡ������д���÷�Ӧ�Ļ�ѧ����ʽ��________________________________________________________�����õ�����1.12L����״���£�ʱ��ת�Ƶĵ�����Ϊ______mol��
��4�����ʱӦ��������������Ӵ���������ܷ�������Ӧ��д��������һ�ֵ�����һ�ֻ����ﷴӦ�Ļ�ѧ����ʽ��_______________________________ ��
��5�������ж�������Ҳ��������������ԭ����_________________________��
��6��ijͬѧ��������������ʵ�飺
����ʢ��KI��Һ���Թ��еμ�������ˮ���ټ�������CCl4�������ú�ɹ۲쵽______________________________��
������������Թ��еμ���ˮ����CCl4������ɫ����dz���������ɫ��������˵����ȷ����___________
a��CCl4�������ʱ����� b��CCl4������
c��CCl4�������ʱ���ԭ d��CCl4����ԭ
��7��������һ�������Դ����������ͨ����ⱥ��ʳ��ˮ���ģ�������������Ƿ�ͬ��ù۵㣿������������Ҫ���͡�______________________________________________
���𰸡���ˮɹ�� ![]() B 2NaCl+2H2O
B 2NaCl+2H2O![]() 2NaOH+H2��+Cl2�� 0.1 Cl2+2NaOH=NaCl+NaClO+H2O ������ˮ�����ɴ����ᣬ��������ǿ�����ԣ���ɱ������ ��Һ�ֲ㣬�ϲ㼸����ɫ���²��Ϻ�ɫ a ͬ�⣬��ⱥ��ʳ��ˮ�ڵõ�������NaOH��Һʱ����ͬʱ���������������������ģ������������ͬ�⣬��ⱥ��ʳ��ˮ�����Ĵ������ܣ����Բ��ʺ�ͨ����ⱥ��ʳ��ˮ���ģ�������������������ɣ�
2NaOH+H2��+Cl2�� 0.1 Cl2+2NaOH=NaCl+NaClO+H2O ������ˮ�����ɴ����ᣬ��������ǿ�����ԣ���ɱ������ ��Һ�ֲ㣬�ϲ㼸����ɫ���²��Ϻ�ɫ a ͬ�⣬��ⱥ��ʳ��ˮ�ڵõ�������NaOH��Һʱ����ͬʱ���������������������ģ������������ͬ�⣬��ⱥ��ʳ��ˮ�����Ĵ������ܣ����Բ��ʺ�ͨ����ⱥ��ʳ��ˮ���ģ�������������������ɣ�
��������
��1���Ӻ�ˮ�л��ʳ��ͨ���������ķ���������ˮɹ�Ρ�NaCl�ĵ���ʽ��![]() ���ʴ�Ϊ����ˮɹ�Σ�
���ʴ�Ϊ����ˮɹ�Σ�![]() ��
��
��2��A.��ֱ����Դ���������ĵ缫�ǵ��ص���������A����
B.�缫b��������������ԭ��Ӧ����B��ȷ��
C.������Cl-�õ���������Cl2������ˮ�õ�����ˮ�����Եģ����˷�̪����Һ�����죬��C����
D.������ˮ���������H+�õ���������H2��H2����ɫ���壬��D����
��ѡB��
��3����ⱥ��ʳ��ˮ��ȡ������ͬʱ�õ�������NaOH����Ӧ�Ļ�ѧ����ʽΪ��2NaCl+2H2O![]() 2NaOH+H2��+Cl2�����õ���״����1.12L��0.05mol������ת�Ƶ��ӵ����ʵ���Ϊ0.05mol��2=0.1mol���ʴ�Ϊ0.1��
2NaOH+H2��+Cl2�����õ���״����1.12L��0.05mol������ת�Ƶ��ӵ����ʵ���Ϊ0.05mol��2=0.1mol���ʴ�Ϊ0.1��
��4�����ʱ�õ���NaOH��Cl2���Է�����Ӧ��Cl2+2NaOH=NaCl+NaClO+H2O��
��5������������������ԭ����������ˮ�����ɴ����ᣬ��������ǿ�����ԣ���ɱ��������
��6������ʢ��KI��Һ���Թ��еμ�������ˮ������������KI���û���Ӧ���û������ĵ������CCl4�������ú�ɹ۲쵽��Һ�ֲ㣬�ϲ㼸����ɫ���²��Ϻ�ɫ��
�ڼ������Թ��еμ���ˮ����CCl4������ɫ����dz���������ɫ�����ܵ�ԭ������ˮ�е�Cl2������I2����ѡa��
��7��Ҫһ��Ϊ�������⣬�����Լ��Ĺ۵�����ɼ��ɡ���ˣ���С�������ֲ�ͬ�Ĺ۵㣺ͬ�⣬��ⱥ��ʳ��ˮ�ڵõ�������NaOH��Һʱ����ͬʱ���������������������ģ������������ͬ�⣬��ⱥ��ʳ��ˮ�����Ĵ������ܣ����Բ��ʺ�ͨ����ⱥ��ʳ��ˮ���ģ����������


 С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д� һ������ϵ�д�
һ������ϵ�д� �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д� �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�������,�������Ӻ������Ӿ�����ͬ�ĵ��Ӳ�����( )
A. Na2S B. MgCl2 C. KCl D. LiF
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȽϹ�ҵ�ϳɰ���Ӵ�����������SO2����������������,����˵���д������( )
A.����������������,��ʹ���˺��ʵĴ���
B.��ѡ���˽ϸߵ��¶�
C.��������ʹ����һ��ԭ�Ϲ����������һ��ԭ�������ʵķ���
D.�������˸�ѹ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��һ����Ҫ�Ļ���ԭ�ϣ�A�IJ���������������һ�����ҵ�ʯ�ͻ���ˮƽ��E�Ǿ��й�����ζ��Һ�塣A��B��C��D��E��һ�������´�����ͼת����ϵ�����ַ�Ӧ���������ﱻʡ�ԣ�

��ش��������⣺
��1����ҵ�ϣ���ʯ�ͻ�ð����͵ķ�����___��
��2����������ʯ�������A�Ĺ����е��м����֮һ������һ��ͬ���칹���к�������������CH3����������ͬ���칹��Ľṹ��ʽ��___��
��3����ӦB��C��Ӧ������Ҫ������Ϊ___��D�����й����ŵ�������___��
��4��д��B+D��E�Ļ�ѧ����ʽ___���÷�Ӧ�����ʱȽϻ�����ʵ����Ϊ����߸÷�Ӧ�����ʣ�ͨ����ȡ�Ĵ�ʩ��___��д������һ�����ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�����ʵ���Ũ�ȵ�Na2CO3��Һ�����в�����ʹ��ҺŨ��ƫ�ߵ���
A.����Na2CO3��������ڳ���ֽ��B.�ܽ�Na2CO3ʱ�ձ�������������ˮ
C.ת��ʱû��ϴ���ձ��Ͳ�����D.������Һ����ߴ���̶�����ƽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������зḻ�ĵ⡣Ϊ�˴Ӻ�������ȡ�⣬ijѧϰС����Ʋ�����������ʵ�飺

��1���������ʵ���в���Ҫ��������_________��ѡ���ţ���
A��![]() B��
B��![]() C��
C��![]() D��
D�� ![]()
��2������۵�ʵ�����������____________���õ��IJ��������У�д�������ƣ�_____________________________________��
��3������ܷ�Ӧ�����ӷ���ʽ��__________________________________��
��4������������л��ܼ������ˮ����ȡ�������˹��̰�����ʵ�������_______________��_______________�������þƾ����汽��������_________________________�������ּ�������
��5�������һ�ּ�����ȡ����ˮ��Һ���Ƿ��е��ʵ�ļ����������ּ�������_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪CCl4Ϊ�ǵ���ʣ�HClΪ����ʣ�������������һ������Cl-���ǣ� ��
A.HCl����B.Һ̬CCl4C.KClO3��ҺD.KCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������ؾ�ʯ(��Ҫ��BaSO4)Ϊԭ�ϣ������������մɹ�ҵ֧���������ᱵ(BaTiO3)![]() �Ĺ����������£�
�Ĺ����������£�
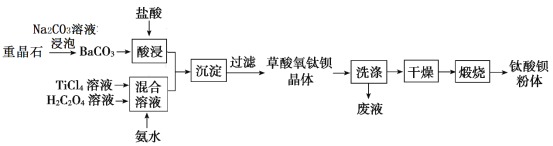
��֪��
(1)Ksp(BaSO4)=1.0��10��10 ��Ksp(BaCO3)=5.0��10-9
(2)�������ѱ�����Ļ�ѧʽΪ BaTiO(C2O4)2��4H2O
�ش��������⣺
(1)Ϊ���BaCO3��������ʣ��ɲ�ȡ�Ĵ�ʩΪ_________(д��һ��)��
(2)����һ��Ũ�ȵ�TiCl4��Һʱ��ͨ���ǽ�TiCl4(������ΪҺ��)________________��
(3)��Na2CO3��Һ���ؾ�ʯ(�������ʲ���Na2CO3��Һ����)�����ﵽƽ��������ϲ���Һ���ظ���β�������BaSO4ת��ΪBaCO3���˷�Ӧ��ƽ�ⳣ��K=______(��д������)����������CO32-��ˮ�⣬��������Ҫʹ��Ũ��Ϊ_____mol/LNa2CO3��Һ�����ؾ�ʯ���ܿ�ʼ��ת�����̡�
(4)���ʵ�鷽����֤�������ѱ������Ѿ�ϴ�Ӹɾ���______________________________��
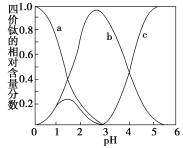
(5)�������ҺҺ�����ڣ���Ԫ���ڲ�ͬpH����Ҫ��TiOC2O4��TiO(C2O4)22-��TiO(OH)+������ʽ���ڣ���ͼ��ʾ��ʵ���Ʊ������У����ð�ˮ���ڻ����Һ��pH��2.5��3֮�䣬�ٽ���������������ͼ������a��Ӧ�ѵ���ʽΪ_____(�ѧʽ)��д����������ʱ�����ӷ���ʽ��___________��
(6)���ղ������ѱ�����õ�BaTiO3����ʽΪ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA��g��+3B��g��2C��g��+2D��g�������ֲ�ͬ����µķ�Ӧ�������£����б�ʾ��Ӧ����������
A. v��A��=0.15molL-1min-1 B. v��B��=0.01molL-1s-1
C. v��C��=0.40molL-1min-1 D. v��D��=0.0075molL-1s-1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com