
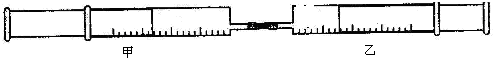
| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒现象 |
| 1 | 10mlFeSO4 | 10mlNH3 | 生成白色沉淀,后变色 |
| 2 | 15mlCl2 | 40mlNH3 |


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、达到平衡后,若只升高温度,化学平衡正向移动 |
| B、达到平衡后,再通人稀有气体,逆反应速率增大 |
| C、使用催化剂,平衡常数不变 |
| D、0~5min内,NO的反应速率为2.4×10-3mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到化学平衡时,N2将完全转化为NH3 |
| B、达到化学平衡时,N2、H2和 NH3的物质的量浓度不一定相等 |
| C、恒温条件下增大压强,平衡向正反应方向移动,平衡常数增大 |
| D、当生成1 mol N2同时又生成 2 mol NH3 时,该反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2溶液中通入Cl2:Fe2++Cl2=2Cl-+Fe3+ |
| B、铝和烧碱溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| C、Fe投入盐酸中:2Fe+6H+=2Fe3++3H2↑ |
| D、碳酸氢镁与足量的NaOH溶液反应:Mg2++2OH-=Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某储能电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色.下列叙述正确的是( )
某储能电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色.下列叙述正确的是( )| A、当右槽溶液颜色由绿色变为紫色时,电池中能量转化形式为化学能转化为电能 |
| B、充电过程中,a极的反应式为VO2+-e-+H2O=VO2++2H+ |
| C、储能电池a、b两极间的电解质溶液中通过电子的定向移动形成闭合回路 |
| D、放电时,当转移的电子数为6.02×1023时,共有1.0 mol H+从右槽迁移进入左槽 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如图所示.又知:①甲、乙、丙均为前三周期元素的单质,常温下均为气态,丁是日常生活中的一种常见金属;②常温下,X是无色液体,Y是黑色固体;③丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色.请回答:
甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如图所示.又知:①甲、乙、丙均为前三周期元素的单质,常温下均为气态,丁是日常生活中的一种常见金属;②常温下,X是无色液体,Y是黑色固体;③丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B、用0.2000mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和 |
| C、为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸,若pH<7,则H2A是强酸 |
| D、相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol?L盐酸、③0.1mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
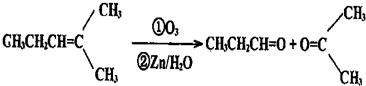

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com