
(1)下列是A、B、C、D、E五种短周期元素的某些性质。
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
①E原子的核外电子排布式为________;
②上表中的元素可以组成分子式为ADC2的物质,该物质中所有原子最外层均满足8电子稳定结构。则该分子的结构简式为________;中心原子的杂化方式为________;
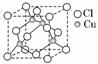
(2)铜的某种氯化物晶体的晶胞结构如图所示,该氯化物的化学式为________;
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
_______________________________________________________________________ _。
_。
科目:高中化学 来源: 题型:
把A、B、C、D四块金属泡在稀硫酸中,用导线两两相连可以组成各种原电池,若A、B相连时,A为负极;C、D相连时,D上有气泡逸出;A、C相连时,A极减轻;B、D相连时,B为正极。则四种金属的活泼性顺序由大到小排列为( )
A.A>B>C>D B.A>C>B>D C.A>C>D>B D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中有关物质的量浓度关系错误的是( )
A.pH=2的HA与pH=12的MOH溶液任意比混合:c(H+) + c(M+) == c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +c(OH-) == c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
在FeCl3和CuCl2混合液中,加入一定量的铁粉,充分反应后,溶液中的金属离子不可能是
A. 仅有Fe2+ B. 有Cu2+ 、Fe2+ 和Fe3+
C. 仅有Cu2+ 和Fe2+ D. 仅有 Fe3+ 和Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列方法均可制得氧气:
(1)2KClO3==2KCl+3O2↑
(2)2BaO2+2H2O===2Ba(OH)2+O2↑
(3)2HgO==2Hg+O2↑
(4)2KMnO4==K2MnO4+MnO2+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为
A.3∶2∶1∶4 B.1∶1∶1∶1 C.2∶1∶2∶2 D.1∶2∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);D原子的基态电子排布式为____________________________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC 的空间构型为________(用文字描述)。
的空间构型为________(用文字描述)。
 (3)1 mol AB-中含有的π键个数为________。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则 LaNin中n=________(填数值);氢在合金中的密度为________。
LaNin中n=________(填数值);氢在合金中的密度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
植物油中的脂肪酸能使皮肤滋润有光泽,若人体长期摄入油脂不足,体内缺乏脂肪,会导致营养不良 ,体力不佳,体重减轻,甚至丧失劳动能力等,下列有关油脂的说法正确的是
( )
A.油脂是人体必不可少的营养物质,在饮食中应尽可能多地食用
B.油和脂肪属于酯类,二者互为同系物
C.油脂一般具有酯类和烯烃的一些性质
D.油脂都可以在酸性条件下发生皂化反应生成甘油和高级脂肪酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法不正确的是 ( )
A.相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱
B.0.1 mol Fe与足量盐酸反应,转移的电子数为0.3NA(NA为阿伏加德罗常数的值)
C.标准状况下,0.3mol二氧化硫中含有氧原子数为0.6NA
D.常温常压下,足量的Fe在1 mol Cl2中充分燃烧,转移的电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com