
【题目】下列有关物质的应用与性质相对应的说法正确的有( )
①光导纤维可用作通讯材料是因为其具有导电性
②明矾能用于净水是因为铝离子水解生成的氢氧化铝胶体具有强氧化性
③浓硫酸可用作干燥剂是因为其具有脱水性
④MgO、Al2O3的熔点很高,可制作耐高温材料
⑤氯化铁溶液可用于制作印刷电路板是因为其能氧化单质铜
⑥NaHCO3能与碱反应,因此食品工业上可用作焙制糕点的膨松剂
⑦A1具有良好的延展性和抗腐蚀性,可制成铝箔包装物品
A. 5个 B. 4个 C. 3个 D. 2个
【答案】C
【解析】①光导纤维的成分是二氧化硅,没有导电性,故①错误;②明矾能用于净水是因为铝离子水解生成的氢氧化铝胶体具有强吸附性,故②错误;③浓硫酸可用作干燥剂是因为其具有吸水性,故③错误;④MgO、Al2O3的熔点很高,可制作耐高温材料,故④正确;⑤氯化铁溶液与单质铜反应生成氯化亚铁和氯化铜,故⑤正确;⑥NaHCO3在食品工业上可用作焙制糕点的膨松剂,是因NaHCO3受热容易分解:2NaHCO3![]() Na2CO3+CO2↑+H2O,故⑥错误; 金属Al具有良好的延展性,由于在空气中能与氧气发生反应产生一薄层致密的氧化物薄膜,对内层的金属来是起到了保护作用。因此有一定的抗腐蚀性能,所以可制成铝箔包装物品,故⑦正确;故选C。
Na2CO3+CO2↑+H2O,故⑥错误; 金属Al具有良好的延展性,由于在空气中能与氧气发生反应产生一薄层致密的氧化物薄膜,对内层的金属来是起到了保护作用。因此有一定的抗腐蚀性能,所以可制成铝箔包装物品,故⑦正确;故选C。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】有机物F(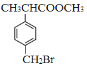 )是合成某种药物的中间体,它的一种合成路线如下:
)是合成某种药物的中间体,它的一种合成路线如下:
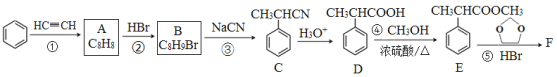
回答下列问题:
(1)A的结构简式为______,分子中处于同一平面的原子最多有____个。
(2)E中官能团名称是_____,①~④中属于加成反应的是_______(填序号)。
(3)反应③的化学方程式为______________。
(4)反应⑤的生成物有两种,除了F以外,另一种生成物的名称是______。
(5)满足下列条件的D的同分异构体有______种。
①能与FeCl3溶液发生显色反应; ②能发生银镜反应; ③分子中有1个甲基
(6)仿照E的合成路线,设计一种由![]() 合成
合成![]() 的合成路线________________________________________。
的合成路线________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是__________________________。
(2)利用实验1中的数据,计算用KMnO4表示的化学反应速率为_____________。(溶液混合前后体积变化可忽略)
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
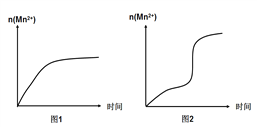
①该小组同学提出的假设是_____________。
②请你帮助该小组同学完成实验方案,并填写表中空白
实验编号 | 室温下,试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
4 | _____________ | 2.0 | 2.0 | 3.0 | MnSO4 | t |
③若该小组同学提出的假设成立,t_____________1.5(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A. 1 mol FeI2与足量氯气反应时转移的电子数为2NA
B. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
C. 18gD2O和18gH2O中含有的质子数均为10NA
D. 1 mol Na2CO3固体中含离子总数小于3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10,现用0.1000 mol·L-1NaOH溶液滴定浓度相近的甲酸时,上述指示剂
A.都可以用B.只能用③
C.可以用①或②D.可以用②或③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9gcm﹣3 , 这种氨水的物质的量浓度和溶质的质量分数分别为( )
A.18.4molL﹣1 34.7%
B.20.4molL﹣1 38.5%
C.18.4molL﹣1 38.5%
D.20.4molL﹣1 34.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列说法正确的是( )
A. 标况下,11.2L CO2中含有氧原子数为2NA
B. 常温下,0.9g H2O中,含有的电子数为0.5NA
C. 标准状况下,2.24L CCl4所含的原子数为0.5NA
D. 1molL-1的Na2SO4溶液中,含Na+的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用回收的合金废料(主要含Fe、Cu、Co、Si、Li)进行深度加工的工艺流程如图:

已知:①Fe、Co、Ni为同族元素,化学性质相似
②Li2CO3微溶于水,其饱和溶液的物质的量浓度与温度关系如表所示
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol/L | 0.21 | 0.17 | 0.14 | 0.10 |
回答下列问题:
(1)流程中残渣M的主要成分为____。
(2)“浸出液”中加入H2O2后,为检测Fe2+是否完全被氧化,最佳试剂为____;加入氨水发生反应的离子方程式为_________________。
(3)为减少Li2CO3的溶解损失,“操作3”应为蒸发浓缩、______、洗涤、干燥。
(4)将CoC2O4·2H2O样品于空气中加热,样品质量随温度变化的曲线如图所示,曲线中300℃及以上所得固体为钴的氧化物。实验室中应置于______(填仪器名称)焙烧样品。通过计算确定C点剩余固体的化学成分为_______;试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:_______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com