
【题目】黄铜是人类最早使用的合金之一,主要由锌和铜组成。回答下列问题:
(1)铜原子核外电子共有______种不同运动状态,基态铜原子的核外占据最高能层电子的电子云轮廓图形状为______。
(2)根据铜、锌原子结构可知第二电离能I2(ZnI2)_____(Cu)填(“大于”或“小于”)。
(3)向蓝色{[Cu(H2O)4]2+}硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色{[Cu(NH3) 4]2+}。
①H2O分子中心原子的杂化类型为______;分子中的键角:H2O_____NH3填(“大于”或“小于”)。
②通过上述实验现象可知,与Cu2+的配位能力:H2O_____NH3(填“大于”或“小于”)。
③氨硼烷(BH3-NH3)可以作为机动车使用的备选氢来源或氢储存的材料。下列与氨硼烷是等电子体的有______(填编号)
A.乙烷 B.H2O2 C.H3PO4 D. S8
④写出BH3-NH3的结构式(结构中若含配位键用表示)_____。
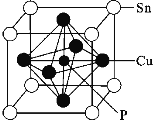
(4)某磷青铜晶胞结构如图所示。
①其化学式为______。
②若晶体密度为8.82g/cm3,最近的Cu原子核间距为______cm(以NA表示阿伏伽德罗常数,用含NA的代数式表示)。
【答案】29 球形 小于 sp3 小于 小于 A ![]() SnCu3P
SnCu3P 
【解析】
(1)在任何原子核外都不存在运动状态完全相同的电子;根据原子核外电子排布的构造原理书写Cu原子核外电子排布式,然后根据不同轨道上电子云的形状;
(2)原子核外电子处于全满、半满或全空时是稳定状态,不容易失去电子;
(3)①根据向CuSO4溶液中加入过量氨水,形成[Cu(NH3)4]2+离子判断;
②配位体的键角大,与中心离子越不容易结合;
③根据等电子体定义判断;
④B与H、N与H原子之间形成共价键,B与N之间形成配位键;
(4)用均摊方法分析物质,判断其化学式,并根据微粒的相对位置及![]() 计算。
计算。
(1)Cu是29号元素,由于在一个原子核外都不存在运动状态完全相同的电子,所以Cu原子核外电子有29种不同运动状态;Cu原子核外电子排布式是1s22s22p63s23d104s1,基态铜原子的核外占据最高能层电子是4s1,其电子云轮廓图形状为球形;
(2)30号元素Zn核外电子排布为1s22s22p63s23d104s2,其第二电离能是Zn+变为Zn2+需消耗的能量,得到Zn2+各个轨道处于全满的稳定状态;而29号Cu核外电子排布为1s22s22p63s23d104s1,其第二电离能是Cu+变为Cu2+需消耗的能量,得到Cu2+,这是由稳定状态1s22s22p63s23d10变为不稳定状态1s22s22p63s23d9,所以第二电离能Zn<Cu;
(3)①H2O中O原子形成了2个σ键,含有的孤电子对数为:![]() =2,价层电子对数为2+2=4,所以H2O分子中心O原子的杂化类型为sp3杂化;
=2,价层电子对数为2+2=4,所以H2O分子中心O原子的杂化类型为sp3杂化;
NH3中N原子形成了3个σ键,含有的孤电子对数为:![]() =1,价层电子对数为3+1=4,所以NH3分子中心N原子的杂化类型为sp3杂化;由于O原子上有2对孤电子对,NH3分子中N原子上只有1对对孤电子对,孤电子对对成键电子的排斥作用大于成键电子之间的排斥作用,使分子中键角减小,所以分子中的键角:H2O<NH3;
=1,价层电子对数为3+1=4,所以NH3分子中心N原子的杂化类型为sp3杂化;由于O原子上有2对孤电子对,NH3分子中N原子上只有1对对孤电子对,孤电子对对成键电子的排斥作用大于成键电子之间的排斥作用,使分子中键角减小,所以分子中的键角:H2O<NH3;
②向CuSO4溶液中加入过量氨水后会形成[Cu(NH3)4]2+离子,说明NH3与Cu2+的配位能力大于水与Cu2+的配位能力,即与Cu2+的配位能力:H2O<NH3;
③等电子体中含有的原子数相等,最外层电子数也相等。
A.乙烷CH3-CH3分子与BH3-NH3互为等电子体,A正确;
B.H2O2分子与BH3-NH3含有的原子个数不同,不能互为等电子体,B错误; C.H3PO4与BH3-NH3含有的原子个数相同,但原子最外层电子数不同,不能互为等电子体,C错误;
D. S8与BH3-NH3含有的原子个数相同,但原子最外层电子数不同,不能互为等电子体,D错误;
故合理选项是A;
④在BH3-NH3的分子中B、N与H原子形成共价键,由于N原子上有孤电子对,而B原子上有空轨道,形成配位键,所以BH3-NH3的分子的结构式为![]() ;
;
(5)①根据物质的晶胞结构可知晶体中含有的P原子个数为1个,Sn原子个数为8×![]() =1;含有的Cu原子个数为6×
=1;含有的Cu原子个数为6×![]() =3,所以该晶体的化学式为SnCu3P;
=3,所以该晶体的化学式为SnCu3P;
②Cu原子位于晶胞6个面中心,面心的6个Cu原子形成正八面体,Cu原子核间距等于正八面体的棱长,而该正八面体棱长等于晶胞棱长的![]() 倍。晶胞质量m=
倍。晶胞质量m=![]() g,由于晶胞的密度ρ=
g,由于晶胞的密度ρ=![]() =8.82 g/cm3,则晶胞体积V=
=8.82 g/cm3,则晶胞体积V=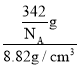 =
=![]() cm3,则晶胞棱长L=
cm3,则晶胞棱长L=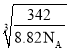 cm,所以最近的Cu原子核间距为
cm,所以最近的Cu原子核间距为 cm。
cm。


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与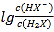 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种新型燃料,工业上一般以CO和H2为原料合成甲醇,CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]() H=-116kJ/mol在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
H=-116kJ/mol在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
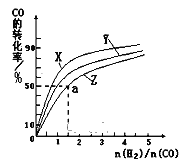
请回答:
①在上述三种温度中,曲线X对应的温度是___。
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)![]() CH3OH(g)的平衡常数 K=___。
CH3OH(g)的平衡常数 K=___。
③下列既能提高上述反应中 CO 的平衡转化率,又能增大反应速率的是__(填标号)。
a.增大压强 b.降低温度 c.增大H2浓度 d.加高效催化剂
④若上述反应在某恒温恒容容器中发生,能说明该反应达到平衡的是___(填标号)。
a.气体平均相对分子质量保持不变 b.△H保持不变
c.![]() 保持不变 d.气体密度保持不变
保持不变 d.气体密度保持不变
⑤在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol/L)变化如表所示:若5min~10min只改变了某一条件,所改变的条件是___。
0min | 5min | 10min | |
CO | 0.1 | 0.05 | |
H2 | 0.2 | 0.2 | |
CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6] 目前广泛用作食品添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg/kg。一种制备黄血盐的工艺如下:
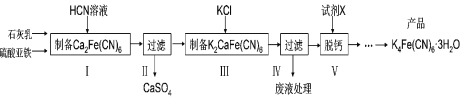
回答下列问题:
(1)步骤I反应的化学方程式为______。
(2)步骤IV过滤所得的废液中含量较多的溶质为______(填化学式)。
(3)步骤V是将难溶的K2CaFe(CN)6与X反应脱钙生成K4Fe(CN)6,所用的试剂X是_____。(填名称)
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。
①25°C时Ka(HCN)=6.25×10-10;计算25℃时0.01molL-1的HCN溶液的pH=____(lg2.5=0.4)。
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN;第二步控制pH为7.58.5,用NaClO溶液完全氧化OCN生成N2和两种盐(其中一种为酸式盐)。
第一步控制强碱性的主要目的是_______,第二步反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量SiO2、Fe的氧化物)为原料制备碳酸镁晶体(MgCO33H2O)。实验过程如下:
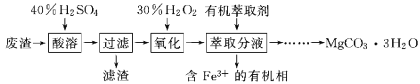
下列说法不正确的是( )
A.为了加快酸溶速率,可将原料进行研磨并适当提高反应温度
B.滤渣的主要成分是H2SiO3和SiO2
C.萃取后,可用KSCN溶液检验水相中是否含有Fe3+
D.萃取后,往水溶液中加入适量的Na2CO3,经过加热蒸发,可得到碳酸镁晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O35H2O,M=248g/mol)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体,具体流程如图:
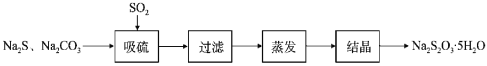
回答下列问题:
(1)吸硫装置如图所示。装置B的作用是检验装置A中SO2的吸收效率,表明SO2吸收效率低的实验现象是_____。
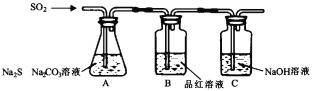
(2)市售硫代硫酸钠中常含有硫酸钠杂质,选用下列试剂设计实验方案进行检验:试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液、无氧蒸镏水,完成下列操作:
实验操作 | 现象 | 结论 |
取少量样品于试管中,加入无氧蒸馏水 | 固体完全溶解 | |
往试管中加入_____ | _______,有刺激性气体产生 | 试样中含有硫代硫酸钠 |
静置,取上层清液,滴加_______ | ______________ | 试样含有硫酸根 |
(3)测定硫代硫酸钠的纯度步骤如下:
①溶液配制:准确取5.0000g产品,配制成250mL溶液,配制溶液的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除_____及二氧化碳。
②滴定:向锥形瓶中加入25.00mL0.01mol/LKIO3溶液,加入过量KI溶液和H2SO4溶液,发生反应:IO3-+5I-+6H+ =3I2+3H2O,然后加入淀粉作指示剂,用硫代硫酸钠样品溶液滴定,发生反应:I2+2S2O32-=S4O62-+2I-。当_____,即为终点。消耗样品溶液的用量为20.00mL,则样品纯度为_____%(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
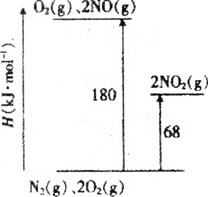
【题目】NO、NO2是汽车尾气中主要的含氮氧化物。回答下列问题:
(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2molNO2的能量变化)。1molNO氧化为NO2的焓变ΔH=___。
(2)某温度下,反应的平衡常数如下:
a.2NO2(g)N2(g)+2O2(g) K=6.7×1016
b.2NO(g)N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是___(填“a”或“b”);反应2NO(g)+O2(g)2NO2(g)的K=___(保留三位有效数字)。
(3)已知反应2NO(g)+O2(g)2NO2的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
起始浓度/molL-1 | |||
组别 | NO | O2 | 初始速率 /molL-1s-1 |
1 | 0.02 | 0.0125 | 7.98×10-3 |
2 | 0.02 | 0.0250 | 15.96×10-3 |
3 | 0.04 | 0 0125 | 31.92×10-3 |
则k1=___,m=___,n=___。
(4)已知该反应的历程为:
第一步:NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),v(逆)=k-1c(N2O2)。下列叙述正确的是___(填字母)。
A.第一步反应的平衡常数K=![]()
B.v(第一步的正反应)<v(第一步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
(5)一定条件下测得容器中NO、O2、NO2浓度发生如图变化。
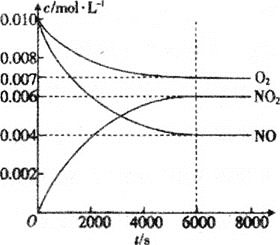
①NO的平衡转化率为___。
②该温度下反应2NO(g)+O2(g)2NO2(g)的平衡常数为___(保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J 是我国自主成功研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:
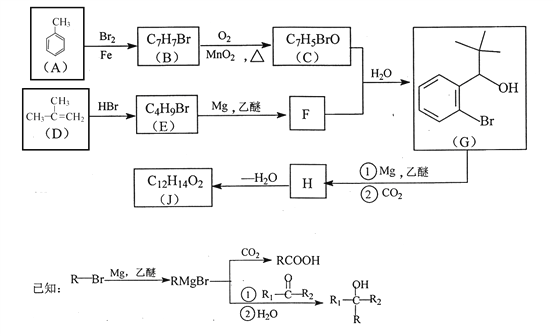
回答下列问题:
(1)B的结构简式是________________。C的结构简式是______________。
(2)D生成 E的化学方程式为_________________。
(3)J的结构简式是________________。在一定条件下,H自身缩聚生成高分子化合物的结构简式是_______________。
(4)根据![]() ,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无一O—O—键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以甲烷和甲苯 为原料,合成![]() 的路线流程图(其它试剂自选):____________________________。
的路线流程图(其它试剂自选):____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米磷酸钙是理想的生物材料,可用作骨骼和牙用骨水泥。将含有脲酶的Na3PO4溶液加入处于高速搅状态的尿素[CO(NH2)2]、CaC12和盐酸混合液中,可制得纳米磷酸钙。
已知:①CO(NH2)2+H2O![]() 2NH3+CO2
2NH3+CO2
②25℃时,H3PO4的Ka1=7.5×10-3 、Ka2=6.3×10-8、Ka3=4.4×10-13;Ca3(PO4)2的Ksp=3.3×10-9。
(1)实验过程若降低搅拌速率,可能造成的不良后果是___________。
(2)尿素水解液呈碱性,则c(![]() )___________ c(
)___________ c(![]() )(填“>”或“<”)
)(填“>”或“<”)
(3)混合后,溶质的初始浓度如下表
物质 | CaCl2 | HCl | NaH2PO4 | NaCl | 尿素 | 脲酶 |
初始浓度 mol/L | 0.25 | 5×10-3 | 0.05 | 1 | 1.0 | 20U/mL |
①生成![]() 的离子方程式为___________。
的离子方程式为___________。
②初始时刻,溶液中含磷微粒浓度从大到小的顺序为___________。
③判断此时能否生成Ca3(PO4)2沉淀___________ (列式计算) 。
(4)上述实验条件下,溶液的浊度、pH与反应时间t的关系如图所示,实验表明,pH在7.8-8.1之间出现周期性振荡,相关分析不正确的是___________ (填序号) 。
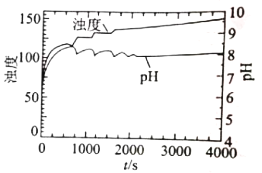
A.振荡周期内,PO43-浓度不变
B.随着尿素水解反应的进行,pH升高
C.随着磷酸钙沉淀的生成,pH下降
D.尿素水解速率和磷酸钙沉淀速率的差异引起pH周期性振荡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com