
 NO2
NO2| Fe/HCl |
 NH2(苯胺,易被氧化)
NH2(苯胺,易被氧化)| 92 |
| 12 |
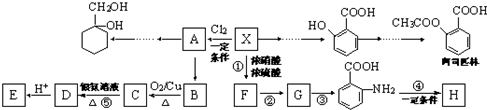
 ,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为
,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为 ,B为
,B为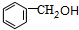 ,C为
,C为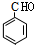 ,D酸化生成E,故D为
,D酸化生成E,故D为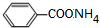 ,E为
,E为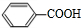 .
. 在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为
在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为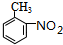 ,F转化生成G,由于苯胺容易被氧化,应先氧化甲基为-COOH,再将硝基还原为氨基,故G为
,F转化生成G,由于苯胺容易被氧化,应先氧化甲基为-COOH,再将硝基还原为氨基,故G为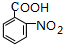 ,H是一种功能高分子,链节组成为C7H5NO,与
,H是一种功能高分子,链节组成为C7H5NO,与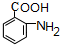 的分子式相比减少1分子H2O,为
的分子式相比减少1分子H2O,为 通过形成肽键发生缩聚反应生成的高聚物,则H为
通过形成肽键发生缩聚反应生成的高聚物,则H为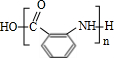 .
.| 92 |
| 12 |
 ,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为
,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为 ,B为
,B为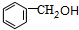 ,C为
,C为 ,D酸化生成E,故D为
,D酸化生成E,故D为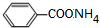 ,E为
,E为 .
. 在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为
在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为 ,F转化生成G,由于苯胺容易被氧化,应先氧化甲基为-COOH,再将硝基还原为氨基,故G为
,F转化生成G,由于苯胺容易被氧化,应先氧化甲基为-COOH,再将硝基还原为氨基,故G为 ,H是一种功能高分子,链节组成为C7H5NO,与
,H是一种功能高分子,链节组成为C7H5NO,与 的分子式相比减少1分子H2O,为
的分子式相比减少1分子H2O,为 通过形成肽键发生缩聚反应生成的高聚物,则H为
通过形成肽键发生缩聚反应生成的高聚物,则H为 ,
, ,反应⑤是醛基与银氨溶液发生的氧化反应,故答案为:
,反应⑤是醛基与银氨溶液发生的氧化反应,故答案为: ;氧化反应;
;氧化反应;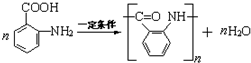 ,故答案为:
,故答案为: ;
;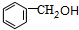 )是否完全转化为C(
)是否完全转化为C( ),官能团发生变化,熔点不同,可以用定量分析法,测熔点进行判断,而苯甲醛、苯甲醇均能被酸性高锰酸钾氧化,苯甲醛与银氨溶液、新制氢氧化铜反应,可以鉴别是否有苯甲醛生成,不能判断苯甲醇是否完全转化为苯甲醛,故选:a.
),官能团发生变化,熔点不同,可以用定量分析法,测熔点进行判断,而苯甲醛、苯甲醇均能被酸性高锰酸钾氧化,苯甲醛与银氨溶液、新制氢氧化铜反应,可以鉴别是否有苯甲醛生成,不能判断苯甲醇是否完全转化为苯甲醛,故选:a.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
| A、2.24L | B、0.2mol |
| C、7.1g | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O,下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O,下列有关说法正确的是( )| A、K与N相接时,电解池密度增大 |
| B、K与N相接时,H+向负极区迁移 |
| C、K与M连接时,所用电源的b极为负极 |
| D、K与M相接时,阳极附近的pH逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
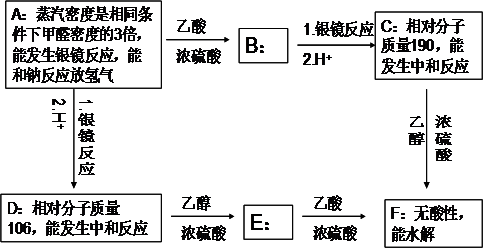
查看答案和解析>>
科目:高中化学 来源: 题型:
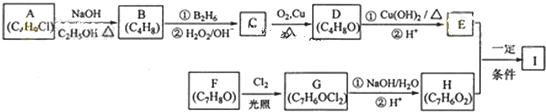
| ①B2H6 |
| ②H2O2/OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
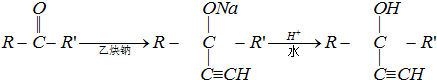
 (碳碳双键)在一定条件下与氧化剂作用,如:
(碳碳双键)在一定条件下与氧化剂作用,如:
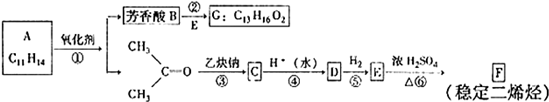
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(HCOOH) |
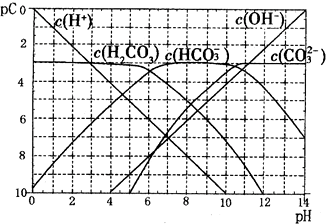
查看答案和解析>>
科目:高中化学 来源: 题型:
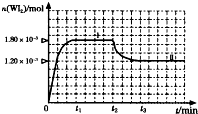 卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.| c(WI2) |
| c(W)?c(I2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com