
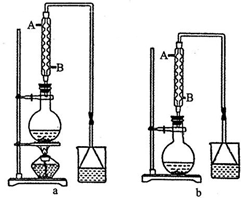
 实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题.
实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题.分析 (1)根据a、b装置的不同点进行解答;
(2)根据相关数据计算,加热时烧瓶内液体的体积应小于烧瓶容积;
(3)冷凝管中采用逆向通水冷凝效果好;
(4)由NaBr、浓H2SO4和乙醇共热生成硫酸氢钠、溴乙烷和水;在浓硫酸作用下,乙醇在170℃发生消去反应生成乙烯,在140℃发生分子间脱水生成乙醚,浓硫酸还能够氧化HBr,据此写出反应的化学方程式;
(5)溴乙烷中含有单质溴显棕黄色,根据溴单质的性质选择除杂试剂;根据分离互不相溶的液体的操作分析;
(6)已知n(乙醇)=0.25mol,然后根据方程式结合转化率来解答.
解答 解:(1)由题给信息可知知该反应为:NaBr+H2SO4(浓)+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O,反应需要加热,所以应采用装置a,
故答案为:a;
(2)烧瓶的规格与所盛液体的体积有关,加热时烧瓶内液体的体积应小于烧瓶的容积的$\frac{2}{3}$,
V(C2H5OH)=$\frac{0.25mol×46g/mol}{0.80g/c{m}^{3}}$=14cm-3=14mL,忽略混合时体积变化,混合后液体的总体积约为36mL+25mL+14mL=75mL,所以150mL的烧瓶最合适,
故答案为:C;
(3)冷凝时,水需充满冷凝器,为了防止冷凝器冷凝时,受热不均匀破裂,冷凝水应下进上出,即:B进A出,
故答案为:B;
(4)由NaBr、浓H2SO4和乙醇共热制备溴乙烷的化学反应方程式为:NaBr+H2SO4(浓)+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O;
可能发生的副反应有:C2H5OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O,2C2H5OH $→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O,2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2+SO2↑+2H2O等,
故答案为:NaBr+H2SO4(浓)+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O;C2H5OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O,2C2H5OH $→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O,2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2+SO2↑+2H2O等;
(5)棕黄色的粗溴乙烷,是由于溴乙烷溶解了Br2的缘故,可用NaOH溶液洗涤除去,溴乙烷难溶于水,可以用分液漏斗分离溴乙烷和水溶液;
故答案为:NaOH溶液;分液漏斗
(6)已知n(乙醇)=0.25mol,实验的产率为60%,则n(溴乙烷)=0.25mol×60%=0.15mol,
反应方程式为:NaBr+H2SO4(浓)+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O,
则m(溴乙烷)=0.15mol×109g/mol=16.35g,
故答案为:16.35.
点评 本题主要考查了溴乙烷的制备,侧重于实验制备方案设计、物质的分离提纯、有关方程式的计算等知识,题目难度中等,明确实验目的、实验原理是解答本题的关键,试题培养了学生的分析、理解能力及化学实验能力.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:解答题
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 26.04 |
| 2 | 0.3000 | 2.00 | 25.02 |
| 3 | 0.3000 | 0.20 | 23.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
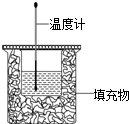 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:用10mLH2O2制取150mLO2所需的时间(秒)
Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:用10mLH2O2制取150mLO2所需的时间(秒)  | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 260 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com