
根据下图的转化关系判断下列说法正确的是(反应条件已略去)
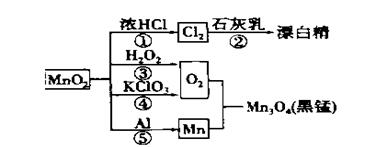
A. 反应①②③④⑤均属于氧化还原反应和离子反应
B. 反应⑤说明该条件下铝可用于制熔点较高的金属
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
【知识点】氧化还原反应 B3 J3
【答案解析】B 解析:A、 反应①②③④⑤均属于氧化还原反应,④不属于离子反应
,故A错误;B、反应⑤为铝热反应,高温下铝可用于制熔点较高的金属,故B正确;C、根据反应方程式,假设都生成1摩尔O2,反应③转移的电子数为2摩尔,反应④转移的电子数为4摩尔,③和④转移的电子数之比为1:2,故C错误;D、反应①的方程式为MnO2+4HCl MnCl2+Cl2+2H2O,4摩尔HCl参与反应时有2摩尔被氧化,所以氧化剂与还原剂的物质的量之比为1:2,故D错误。
MnCl2+Cl2+2H2O,4摩尔HCl参与反应时有2摩尔被氧化,所以氧化剂与还原剂的物质的量之比为1:2,故D错误。
故答案选B
【思路点拨】本题考查了氧化还原反应的分析和应用,双氧水分解与氯酸钾分解制等量氧气转移的电子不同属于易错点。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
(1)有机物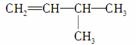 的系统名称是______________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________。
的系统名称是______________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________。
(2)有机物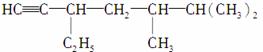 的系统名称是
的系统名称是
____________________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、SCN-、Br-可以大量存在
B.和KI溶液反应的离子方程式: Fe3++2I- =Fe2++I2
C.和Ba(OH)2溶液反应离子方程式:Fe3++ SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓
D. 1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列各溶液中,离子一定能大量共存的是: ( )
A.pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
B.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.无色溶液中:K+、Na+、MnO4-、SO42-
D.室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
.下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
| 选项化合物 | A | B | C | D |
| Y | CO2 | Fe2O3 | SiO2 | FeCl3 |
| W | MgO | Al2O3 | CO | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y·zH2O。某校化学兴趣小组欲测定其化学式,实验设计如下:
实验Ⅰ:称取一定质量的A,加热分解至恒重。
实验Ⅱ:称取一定质量的A,与足量的酸反应,测量生成CO2气体的质量。
可供选择的仪器和药品如图所示:(酸溶液限选6 mol·L-1盐酸或6 mol·L-1硫酸,其他试剂任选)
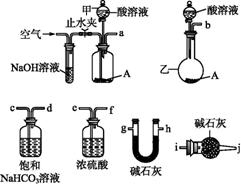
回答下列问题:
(1)仪器乙的名称为 。
(2)请选择必要的装置完成实验Ⅱ,正确的连接顺序为 (按气流方向,用接口字母表示);选用的酸溶液是 。
(3)有人提出不采用实验Ⅰ,可在实验Ⅱ结束后,在A完全反应后所得溶液中滴加足量的氨水,用无灰滤纸过滤,用蒸馏水洗涤反应容器2~3次,将洗涤液过滤,洗涤沉淀2~3次,将附着沉淀的滤纸放到坩埚中加热分解至恒重。判断沉淀已洗涤干净的方法是 ,实际上 未采用该方案的原因是不符合实验设计的 (填字母编号)原则。
未采用该方案的原因是不符合实验设计的 (填字母编号)原则。
A.科 学性 B.安全性
学性 B.安全性
C.可行性 D.简约性
(4)x与y的关系式是 (用等式表示)。
(5)通过实验Ⅰ的相关数据,经计算可得A的摩尔质量为602.0 g·mol-1。实验Ⅱ中称得样品A的质量为9.030 g,与足量酸完全反应后,CO2吸收装置增重0.660 g,则A的化学式为  。
。 
查看答案和解析>>
科目:高中化学 来源: 题型:
烟道气中的CO2可用于合成甲醇和甲醚。
(1)下图所示为其中的一种方法:
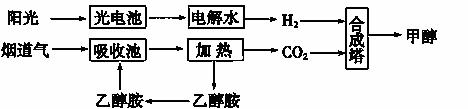
①用光电池电解水时,阳极的电极反应式为__________________________________。
②15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,则HOCH2CH2NH3Cl的水溶液显________(填“酸”“碱”或“中”)性。
③已知,CH3OH(l)+ O2(g)===CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
H2(g)+ O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l)的热化学方程式为
________________________________________________________________________。
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)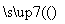 CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是________(填序号)。
a.生成1 mol CH3OCH3(g)的同时,生成3 mol H2O(l)
b.体系中混合气体的密度不随时间而变化
c.体系中CO2与H2的体积比为1∶3
d.体系中的气体的总压强不随时间而变化
②已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比 | 500 K | 600 K | 700 K |
| 1.5 | 45% | 33% | 20% |
| x | a | b | c |
上述反应的化学平衡常数的表达式为__________。该反应的焓变ΔH________0(填“>”、“<”或“=”,下同),若使a>45%,则x________1.5。
③在一定温度下,向体积为0.5 L的密闭容器中加入2 mol CO2和6 mol H2,20 min后达到平衡,测得平衡时CH3OCH3为0.5 mol,则该反应的反应速率v(CO2)=____mol·L-1·min-1,H2的转化率α(H2)=______;加入催化剂,v(CO2)________(填“增大”、“减小”或“不变”,下同),α(H2)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1814年戴维发现了一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物。
(1)氯元素在元素周期表中的位置是_________;ICl的电子式为____________。
(2)ICl与冷的NaOH稀溶液反应的离子方程式为____________________。
(3)用海带制碘时,生成的粗碘中常混有ICl,可加入KI加热升华提纯,发生化学反应的化学方程式为_____________________。
(4)三氯化碘常以二聚体I2Cl6的形式存在,经电导仪测定知,它能发生部分电离,生成的两种离子的相对质量分别为198和269,其电离方程式为_________________________。下列说法正确的是______。
a.ICl3分子中各原子均达到8电子稳定结构
b.由反应KClO3+I2+6HCl=2ICl3+KCl+3H2O,可知还原性:KClO3>ICl3
c.ICl与乙烯反应的化学方程式为CH2=CH2+ICl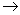 ICH2CH2Cl
ICH2CH2Cl
d.ICl与苯反应制取碘苯的化学方程式为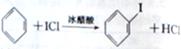
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com