
【题目】某课外活动小组利用如图所示的装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等固定装置已略去.实验时,先加热玻璃管中的铜丝,约1min后鼓入空气.请填写下列空白: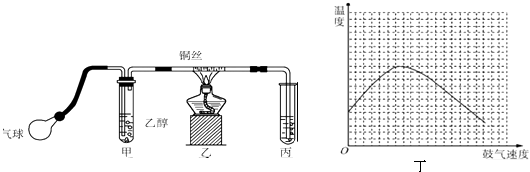
(1)检验乙醛的试剂是(填字母).
A.银氨溶液
B.碳酸氢钠溶液
C.新制Cu(OH)2
D.氧化铜
(2)乙醇发生催化氧化反应的化学方程式为: .
(3)实验时,常常将甲装置浸在70~80℃的水浴中,目的是 , 由于装置设计上的缺陷,实验进行时可能会 .
(4)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反 应继续进行.进一步研究表明,鼓气速度与反应体系的温度关系曲线如图丁所示.试解释鼓气速度过快,反应体系温度反而下降的原因 , 该实验中“鼓气速度”这一变量你认为可用来估量.
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色.该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应.请你设计一个简单的实验,探究哪一种猜想正确? .
【答案】
(1)AC
(2)2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
(3)适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流;发生倒吸
(4)过量的气体将体系中的热量带走;单位时间内甲中的气泡量
(5)用pH试纸检测溴水与褪色后溶液的酸碱性.若酸性明显增强,则猜想①正确;反之,猜想②
【解析】解:(1)乙醛中具有醛基,能够被银氨溶液、新制的氢氧化铜氧化,可以使用银氨溶液或新制氢氧化铜溶液来检验,故选:A C;(2)乙醇催化氧化生成乙醛和水,化学方程式:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;所以答案是:2CH3CH2OH+O2
2CH3CHO+2H2O;所以答案是:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;(3)甲装置常常浸在温度为70~80的水浴中,水浴能使容器受热均匀,能使甲中乙醇平稳气化成乙醇蒸气;导气管直接插入丙溶液内,生成的乙醛和过量的乙醇易溶于水而使丙装置产生倒吸现象,所以答案是:适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流;发生倒吸;(4)反应放出的热的多少和乙醇以及氧气的量有关,鼓气多反应放热多,所以开始阶段温度升高,但是过量的气体会将体系中的热量带走,所以后阶段温度降低,实验中“鼓气速度”这一变量可通过观察甲中冒气泡的速度看出来,所以答案是:过量的气体会将体系中的热量带走;单位时间内甲中的气泡数;(5)乙醛具有还原性,乙醛被溴水氧化生成乙酸和HBr,溶液呈酸性;乙醛分子中含有不饱和键,溴水可能与乙醛发生加成反应,没有HBr生成,溶液不呈酸性,所以检验褪色后溶液的酸碱性,确定其发生哪类反应,故操作方法为:用pH试纸检测溴水与褪色后溶液的酸碱性,若酸性明显增强,则猜想①正确,反之猜想②正确,
2CH3CHO+2H2O;(3)甲装置常常浸在温度为70~80的水浴中,水浴能使容器受热均匀,能使甲中乙醇平稳气化成乙醇蒸气;导气管直接插入丙溶液内,生成的乙醛和过量的乙醇易溶于水而使丙装置产生倒吸现象,所以答案是:适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流;发生倒吸;(4)反应放出的热的多少和乙醇以及氧气的量有关,鼓气多反应放热多,所以开始阶段温度升高,但是过量的气体会将体系中的热量带走,所以后阶段温度降低,实验中“鼓气速度”这一变量可通过观察甲中冒气泡的速度看出来,所以答案是:过量的气体会将体系中的热量带走;单位时间内甲中的气泡数;(5)乙醛具有还原性,乙醛被溴水氧化生成乙酸和HBr,溶液呈酸性;乙醛分子中含有不饱和键,溴水可能与乙醛发生加成反应,没有HBr生成,溶液不呈酸性,所以检验褪色后溶液的酸碱性,确定其发生哪类反应,故操作方法为:用pH试纸检测溴水与褪色后溶液的酸碱性,若酸性明显增强,则猜想①正确,反之猜想②正确,
所以答案是:用pH试纸检测溴水与褪色后溶液的酸碱性.若酸性明显增强,则猜想①正确,反之猜想②正确.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将下列各组物质按酸、碱、盐分类顺序排列,正确的是
A. 硫酸、纯碱、石膏 B. 氢硫酸、烧碱、绿矾
C. 碳酸、乙醇、醋酸钠 D. 磷酸、熟石灰、苛性钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是( )
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序:c(Cl﹣)>c(NH ![]() )>c(H+)=c(OH﹣)
)>c(H+)=c(OH﹣)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
(1)Ⅰ.将钠、钾、镁、铝各1mol分别投入到足量的0.1molL﹣1的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应最慢.
(2)将NaOH溶液与NH4Cl溶液混合生成NH3H2O,从而验证NaOH的碱性大于NH3H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: , .
(3)Ⅱ.利用如图装置可以验证非金属性的变化规律.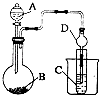
仪器A的名称为 , 干燥管D的作用是 .
(4)实验室中现有药吕Na2S、KMnO4、浓盐酸、MnO2 , 请选择合适药品设计实验验证氯的非金属性大于硫;装置A、B、C中所装药品分别为、、 . 装置C中实验现象为有淡黄色沉淀生成,离子方程式为 .
(5)若要证明非金属性:C>Si,则A中 , B中加Na2CO3、C中加 , 观察到C中溶液的现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的物质的量分数为( )
A.75%
B.25%
C.88%
D.32%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①~⑩为短周期元素,其常见化合价与原子序数的关系如下图所示。请回答下列问题。
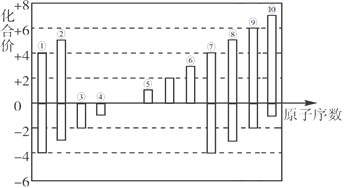
(1)④、⑩的简单离子半径由大到小的顺序为_______(填离子符号)。
(2)由上述元素形成的、稳定性最好的气态氢化物的电子式为_______。
(3)②的简单氢化物与其最高价氧化物的水化物可以发生化合反应,所得产物中包含的化学键类型为_________________。
(4)⑧、⑩的最高价氧化物的水化物的酸性________>________(填化学式)。
(5)写出⑥的单质和⑤的最高价氧化物对应水化物的水溶液之间反应的离子方程式:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NH3和HCl都是能用来做喷泉实验的气体.若在同温同压下用等体积烧瓶一个收集满NH3 , 另一个收集HCl和N2的混合气体,如图所示.喷泉实验停止后,两个烧瓶内溶液的关系是(不考虑烧瓶内溶质的扩散,氨水的溶质按NH3计算)( ) 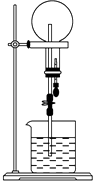
A.溶质的物质的量浓度相同、溶质的质量分数不同
B.溶质的质量分数相同、溶质的物质的量浓度不同
C.溶质的物质的量浓度和溶质的质量分数都不同
D.溶质的物质的量浓度和溶质的质量分数都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5 , 依次发生的分解反应为①N2O5(g)N2O3(g)+O2(g),②N2O3(g)N2O(g)+O2(g);在2L密闭容器中充入6mol N2O5 , 加热到t℃,达到平衡状态后O2为8mol,N2O3为3.2mol.则t℃时反应①的平衡常数为( )
A.10.7
B.8.5
C.32
D.64
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com