
| ||
| A、该反应中氧化产物是N2、NH3,还原产物是SO2、Fe2O3 |
| B、1mol摩尔盐强热分解时转移电子的物质的量为4NA |
| C、向摩尔盐溶液中滴入足量浓NaOH溶液,最终得到刺激性气味的气体和白色沉淀 |
| D、常温下,摩尔盐的溶解度比FeSO4、(NH4)2SO4大 |
| ||


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
| A、4、3、5 |
| B、4、3、6 |
| C、2、5、4 |
| D、4、6、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、由C(石墨)→C(金刚石)△H=+119 kJ?mol-1可知,石墨比金刚石稳定 |
| C、生成物中全部化学键形成时所释放的能量大于破坏反应物中全部化学键所吸收的能量时,反应为吸热反应 |
| D、在101 kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PH3是非极性分子 |
| B、PH3中有孤电子对 |
| C、PH3是一种强氧化剂 |
| D、PH3分子中P-H键是非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子键被破坏的变化一定是化学变化 |
| B、含有金属阳离子的晶体中一定有阴离子 |
| C、分子晶体中分子间作用力越大,分子越稳定 |
| D、NaCl熔化时离子键被破坏,冰熔化时分子中共价键没有断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、改用98%的浓硫酸 |
| B、使用更小颗粒的锌粒 |
| C、滴入少量CuSO4溶液 |
| D、加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
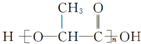 ,有关W的信息如下,其中B能使溴水褪色,C是一个六元状化合物,据此回答下列问题.
,有关W的信息如下,其中B能使溴水褪色,C是一个六元状化合物,据此回答下列问题.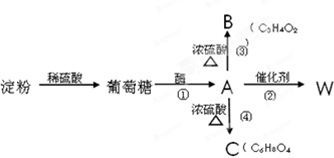
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com