
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
分析 n(Fe)=$\frac{5.21}{56}$mol=0.093mol,n(KNO3)=$\frac{2.53g}{101g/mol}$=0.025mol,亚铁离子被硝酸钾氧化,但是还有一部分亚铁离子倍氯气氧化,根据消耗的氯气的量,计算硝酸钾样啊虎的亚铁离子的量,根据电子守恒计算KNO3的还原产物氮元素的化合价即可.
解答 解:n(Fe)=$\frac{5.21}{56}$mol=0.093mol,n(KNO3)=$\frac{2.53g}{101g/mol}$=0.025mol,亚铁离子被硝酸钾和氯气氧化,根据Cl2~2Fe2+,所以氯气氧化了0.018mol的亚铁离子,所以被硝酸钾氧化的亚铁离子是0.093mol-0.018mol=0.075mol,根据电子守恒,设KNO3的还原产物氮元素的化合价是x,则0.075(3-2)=0.025(5-x),解得x=2,故选B.
点评 本题考查氧化还原反应的计算,侧重考查分析和计算能力,注意从转移电子角度进行计算是关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,不能与任何酸溶液反应 | |
| B. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 | |
| C. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏大 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铅蓄电池放电时负极质量减少 | |
| B. | 在海轮外壳连接镁合金保护外壳不受腐蚀 | |
| C. | 对于同一个化学反应,一步完成和分步完成其反应的焓变亦不相同 | |
| D. | 反应 MnO4-+H2O2+H+═Mn2++H2O+O2(未配平)中每生成1 mol O2转移2 mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 未氧化前合金的质量为5.44g | B. | V=448,它是H2和SO2的混合气体 | ||
| C. | 样品中CuO的质量为4.0g | D. | 滤液A中的阳离子为Fe2+、Fe3+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,
, .写出H→I的反应方程式
.写出H→I的反应方程式 .
. 或
或 .
.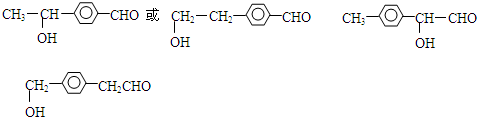 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | Cu溶于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm. |
| Y | 所在主族序数与所在周期序数之差为4. |
| Z | 原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰. |
| D | 最高价氧化物对应的水化物,能电离出离子数、电子数都相等的阴、阳离子. |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量Mg(OH)2固体可溶于较浓的NH4Cl溶液中:Mg(0H)2+2NH4+=Mg2++2NH3•H2O | |
| B. | 在CuSO4溶液中加入pbs,可转变为铜蓝(CuS):Cu2++Pbs=Pb2++CuS | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(0H)2溶液至SO42-沉淀完全:2A13++3SO42-+3Ba2++60H-=3BaS04↓+2A1(0H)3↓. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com