【答案】
分析:(1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器分析;
(2)根据实验操作的方法分析;
(3)根据实验操作的方法分析;
(4)玻璃棒所起的作用常见的有搅拌、引流、转移固体等;
(5)根据c=
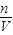
分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答:解:(1)配制顺序是:计算→称量→溶解、冷却→移液→定容→摇匀→装瓶→贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶、烧杯、胶头滴管;
(2)A、氢氧化钠为易潮解的固体,应放在玻璃器皿中称量,但不需要在另一盘上放上烧杯,故A错误;
B、因氢氧化钠固体溶解水放热,应并冷却至室温,然后转移到容量瓶中,否则会引起误差,故B正确;
C、某同学在定容时,不小心加水超过刻度线,又将多余的液体吸出直至刻度线,导致部分溶质被吸出,导致配制的浓度偏低,故C错误.
D、某同学在溶解、转移完氢氧化钠溶液后,将溶解用的仪器洗涤2~3次,并将洗涤液转移到容量瓶中,这样确保溶质全部转移到容量瓶中,故D正确;
故选:BD;
(3)①转移时除了将溶液转移到容量瓶中还要将洗涤液转移到容量瓶中,故①正确;
②洗涤时要洗涤烧杯及玻璃棒2-3次,故②正确;
③将称量好的药品放到烧杯中溶解,只有1次,故 ③错误;
④称量时先称空烧杯的质量再称烧杯和药品的质量,故④正确;
⑤定容时,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,只有1次,故⑤错误;
⑥固体在烧杯中溶解,冷却后转移到500mL容量瓶中,只有1次,故⑥错误;
故选:①②④;
(4)用玻璃棒搅拌加速氢氧化钠的溶解,转移液体时用玻璃棒引流.故答案为:搅拌;引流;
(5)①称量氢氧化钠时,直接放到托盘天平上称量,因氢氧化钠潮解,吸水,称得的氢氧化钠质量偏小,浓度偏小,故答案为:偏低;
②定容摇匀后,有少量溶液外流,因漏出的液体和瓶中液体的浓度一致,故答案为:不影响.
点评:本题考查了一定物质的量浓度的配制.要注意溶质的性质、同时要记住操作步骤,规范操作.

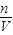 分析操作对溶质的物质的量或对溶液的体积的影响判断.
分析操作对溶质的物质的量或对溶液的体积的影响判断.

 阅读快车系列答案
阅读快车系列答案