
【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
选项 | ①中物质 | ②中物质 | 预测中的现象 |
A | 稀盐酸 | 碳酸钠、氢氧化钠混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |

A.A
B.B
C.C
D.D
【答案】D
【解析】解:A.先发生盐酸与NaOH的反应,然后盐酸与碳酸钠反应生成碳酸氢钠,最后盐酸与碳酸氢钠反应生成气体,则现象不合理,故A错误; B.常温下,Al遇浓硝酸发生钝化,则不能观察到红棕色气体,现象不合理,故B错误;
C.NaOH过量,开始不生成沉淀,反应生成偏铝酸钠和氯化钠,开始无现象,故C错误;
D.草酸与高锰酸钾发生氧化还原反应,溶液褪色,现象合理,故D正确;
故选D.
A.稀盐酸先和NaOH反应生成氯化钠和水,然后再和碳酸钠反应生成碳酸氢钠,最后碳酸氢钠和稀盐酸反应生成二氧化碳;
B.常温下,浓硝酸和铝发生钝化现象;
C.NaOH过量,开始不生成沉淀;
D.发生氧化还原反应.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】3.15消费者权益保护日,据统计,投诉最多的是建筑装潢质量。其中质量问题之一是装潢装饰材料中某些化学成分含量太高,缓慢释放出来,在空气中浓度过高,影响人体健康。某些化学成分主要是( )
A.一氧化碳B.二氧化硫C.甲醛、甲苯等有机物蒸气D.臭氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y混合气体在密闭容器中发生反应:aX(g)+bY(g)![]() cZ(g) ΔH<0;达到化学平衡后,测得X气体的浓度为0.5 mol/L;恒温条件下将密闭容器的容积扩大一倍并再次达到平衡时,测得X气体的浓度为0.3 mol/L。则下列叙述正确的是
cZ(g) ΔH<0;达到化学平衡后,测得X气体的浓度为0.5 mol/L;恒温条件下将密闭容器的容积扩大一倍并再次达到平衡时,测得X气体的浓度为0.3 mol/L。则下列叙述正确的是
A.平衡向右移动 B.a+b>c
C.Y的转化率提高 D.Z的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)甲基的电子式
(2)乙炔的结构式
(3)相对分子质量为72且沸点最低的烷烃的结构简式
(4)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
工业生产甲醇的常用方法是:CO(g)+2H2(g)CH3OH(g)△H=﹣90.8kJ/mol.
已知:2H2(g)+O2(g)=2H2O (l)△H=﹣571.6kJ/mol
H2(g)+ ![]() O2(g)=H2O(g)△H=﹣241.8kJ/mol
O2(g)=H2O(g)△H=﹣241.8kJ/mol
①H2的燃烧热为kJ/mol.
②CH3OH(g)+O2(g)CO(g)+2H2O(g)的反应热△H= .
③若在恒温恒容的容器内进行反应CO(g)+2H2(g)CH3OH(g),则可用来判断该反应达到平衡状态的标志有 . (填字母)
A.CO百分含量保持不变 B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变 D.CO的生成速率与CH3OH的生成速率相等
(5)将水蒸气通过红热的炭即可产生水煤气.反应为:C(s)+H2O(g)CO(g)+H2(g)△H=+131.3kJmol﹣1
能使化学反应速率加快的措施有(填序号).
①增加C的物质的量 ②升高反应温度
③随时吸收CO、H2转化为CH3OH ④密闭定容容器中充入CO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料
NaNO2有毒,具有较强氧化性和较弱还原性,NaNO2溶液显碱性,国家规定肉制品中NaNO2含量不能超过30mg/kg.
(1)NaNO2溶液显碱性的原因是(用离子方程式表达)
活动二:鉴别NaNO2与食盐
(2)可用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是(填化学式)
活动三:探究NaNO3与NaNO2的相互转化
(3)制取NaNO2与NaNO3混合溶液的装置示意图如图. 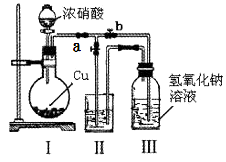
已知:2NO2+2NaOH═NaNO2+NaNO3+H2 O
①装置II中的试剂不能为水,理由是 .
②装置III中反应完全后,接下来的操作是打开活塞(选填“a”或“b”,下同),关闭活塞
(4)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,则溶液中NaNO2的含量(选填“增多”、“减少”、或“不变”),原因可能是(用化学方程式解释).
活动四:检测熟肉中NaNO2含量的变化
(5)分别从 1000g刚煮熟的肉和 1000g隔夜熟肉中提取NaNO2 , 配成溶液,再分别用0.00500mol/L酸性高锰酸钾溶液滴定,刚煮熟的肉消耗12.00mL,隔夜熟肉消耗16.00mL.(提示:MnO4一转化为Mn2+ , NO2一转化为NO3一)
①在该滴定实验中需要用到的实验仪器有
A.容量瓶 B.酸式滴定管 C.碱式滴定管
D.分液漏斗 E.锥形瓶 F. 烧瓶
②滴定终点的判断依据为 .
③隔夜熟肉中NaNO2的含量是mg/kg,该数据说明保存得当的隔夜熟肉(选填“能”或“不能”)食用.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol N2和3 mol H2充入一个容积固定的密闭容器中,发生反应:N2(g)+3H2(g)![]() 2NH3(g)。当反应达到平衡时NH3为n mol。在与上述完全相同的容器中,保持温度不变,若平衡时NH3仍为n mol,则下列组合中不正确的是
2NH3(g)。当反应达到平衡时NH3为n mol。在与上述完全相同的容器中,保持温度不变,若平衡时NH3仍为n mol,则下列组合中不正确的是
选项 | 起始状态/mol | ||
N2 | H2 | NH3 | |
A | 2 | 0 | 2 |
B | 2.5 | 1.5 | 1 |
C |
| 2 |
|
D | 0 | 0 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 直到因加入一滴盐酸后,溶液由黄色变为橙色,并为止.
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示:所用盐酸溶液的体积为 mL.
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(D)酸式滴定管在滴定前有气泡,滴定后气泡消失
(4)某学生根据三次实验分别记录有关数据如表:请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:(NaOH)=(保留小数点后4位).
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000molL﹣1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间.下列有关描述错误的是( ) 
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe﹣2e﹣→Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 摩尔是将一定数目的原子、离子或分子等微观粒子与可称量物质联系起来的一个物理量
B. 物质的量既表示物质的数量又表示物质的质量
C. 阿伏加德罗常数是12 kg 12C中含有的碳原子数目
D. 1 mol H2O中含有10 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com