
【题目】控制适当的条件,将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
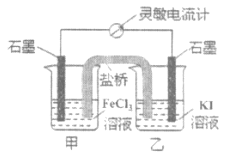
A.反应开始时,乙中电极反应为2I--2e-=I2
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.平衡时甲中溶入FeCl2固体后,电流计指针不偏转
科目:高中化学 来源: 题型:
【题目】乙苯催化脱氢制苯乙烯反应:

下列说法中不正确的是( )
A. 乙苯的一氯代物共有3种不同结构
B. 苯乙烯和氢气生成乙苯的反应属于加成反应
C. 苯乙烯分子中所有原子有可能位于同一平面上
D. 等质量的苯乙烯和聚苯乙烯燃烧耗氧量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧(![]() )在
)在![]() 催化下能将烟气中的
催化下能将烟气中的![]() 、
、![]() 分别氧化为
分别氧化为![]() 和
和![]() ,
,![]() ,也可在其他条件下被还原为
,也可在其他条件下被还原为![]() 。
。
(1)![]() 中心原子轨道的杂化类型为__________;
中心原子轨道的杂化类型为__________;![]() 的空间构型为__________(用文字描述)。
的空间构型为__________(用文字描述)。
(2)与![]() 分子互为等电子体的一种阴离子为__________(填化学式)。
分子互为等电子体的一种阴离子为__________(填化学式)。
(3)![]() 分子中
分子中![]() 键与
键与![]() 键的数目比
键的数目比![]() __________。
__________。
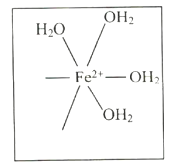
(4)![]() 与
与![]() 反应生成的
反应生成的![]() 中,
中,![]() 以
以![]() 原子与
原子与![]() 形成配位键。请在
形成配位键。请在![]() 结构示意图的相应位置补填缺少的配体_________。
结构示意图的相应位置补填缺少的配体_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的合成路线如图所示:
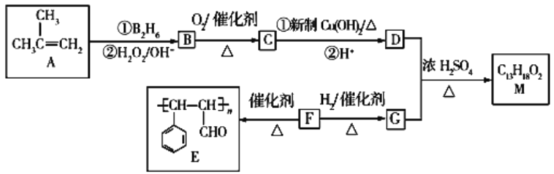
已知:R—CH=CH2![]() R—CH2CH2OH。
R—CH2CH2OH。
请回答下列问题:
(1)有机物B的系统命名为___。
(2)F中所含官能团的名称为___,F→G的反应类型为___。
(3)M的结构简式为___。
(4)B→C反应的化学方程式为___。
(5)X是G的同系物,且相对分子质量比G小14,X有多种同分异构体,满足与FeCl3溶液反应显紫色的有___种。其中核磁共振氢谱显示有4种不同化学环境的氢,且峰面积比为1∶1∶2∶6的结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是一种大气污染物,但它在化工和食品工业上却有广泛应用。某兴趣小组同学对SO2的实验室制备和性质实验进行研究。
(1)甲同学按照教材实验要求设计如图所示装置制取SO2
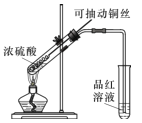
①本实验中铜与浓硫酸反应的化学方程式是 ______,铜丝可抽动的优点是_______。
②实验结束后,甲同学观察到试管底部出现黑色和灰白色固体,且溶液颜色发黑。甲同学认为灰白色沉淀应是生成的白色CuSO4夹杂少许黑色固体的混合物,其中CuSO4以白色固体形式存在体现了浓硫酸的________性。
③乙同学认为该实验设计存在问题,请从实验安全和环保角度分析,该实验中可能存在的问题是________。
(2)兴趣小组查阅相关资料,经过综合分析讨论,重新设计实验如下(加热装置略):
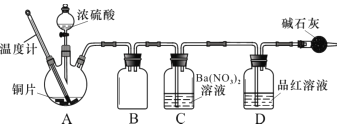
实验记录 A 中现象如下:
序号 | 反应温度/℃ | 实验现象 |
1 | 134 | 开始出现黑色絮状物,产生后下沉,无气体产生 |
2 | 158 | 黑色固体产生的同时,有气体生成 |
3 | 180 | 气体放出的速度更快,试管内溶液为黑色浑浊 |
4 | 260 | 有大量气体产生,溶液变为蓝色,试管底部产生灰白色固体,品红溶液褪色 |
5 | 300 | 同上 |
查阅资料得知: 产物中的黑色和灰白色固体物质主要成分为 CuS、Cu2S 和 CuSO4,其中CuS 和 Cu2S为黑色固体,常温下都不溶于稀盐酸,在空气中灼烧均转化为CuO和SO2。
①实验中盛装浓硫酸的仪器名称为 ____________。
②实验记录表明__________对实验结果有影响,为了得到预期实验现象,在操作上应该____________。
③装置C 中发生反应的离子方程式是 ___________________。
④将水洗处理后的黑色固体烘干后,测定灼烧前后的质量变化,可以进一步确定黑色固体中是否一定含有 CuS其原理为__________(结合化学方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子液体是一种由离子组成的液体,在低温下也能以液态存在,是一种很有研究价值的溶剂。研究显示最常见的离子液体主要由图示正离子和负离子组成:

回答下列问题:
(1)按电子排布,Al划分在元素周期表中的______区(填“s”“p”“d”或“ds”),图中负离子的空间构型为____________________。
(2)基态Cl原子的价电子排布图为____________________。
(3)图中正离子有令人惊奇的稳定性, 它的电子在其环外结构中高度离域。该正离子中C原子的杂化方式为_________。该化合物中不存在____(填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键 E.氢键
(4)C、N、H三种元素的电负性由大到小的顺序为 __________,NH3与CH4的中心原子均为 sp3杂化,但是H-N-H 的键角小于H-C-H的键角,原因是________。
(5)AlN是一种陶瓷绝缘体,具有较高的导热性和硬度, 其立方晶胞如图所示,Al原子周围紧邻的Al原子有_____个。已知:氮化铝的密度为dg/cm3, 阿伏加德罗常数为NA,则最近的N原子与Al原子间的距离为_____________pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如图:

下列说法正确的是
A. 反应①、②均是取代反应
B. 反应③、④的原子利用率均为100%
C. 与乙酸乙酯互为同分异构体的酯类化合物有2种
D. 乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/L某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A. 溶液中水电离出的c(H+)=10-10 mol/L
B. 溶液中c(H+)+c(A-)=0.1 mol/L
C. 溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D. 与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)具有强氧化性,受热易分解,可作漂白剂、食品消毒剂等。
Ⅰ.亚氯酸钠的制备
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
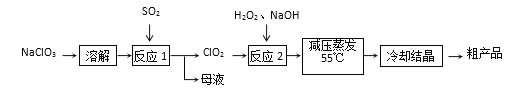
(1)提高“反应1”反应速率的措施有__________________(答出一条即可)。母液中溶质的主要成分是___________(填化学式)。
(2)每有1mol SO2参加反应,理论上可生成ClO2的物质的量为________mol。
(3) “反应2”的化学方程式为_____________________________________。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是____________________。
(5)“反应2”中使用H2O2而不用其他物质的原因是____________________。
Ⅱ.亚氯酸钠的应用
(6)用亚氯酸钠作水处理剂,水中可能残留少量亚氯酸钠,可以加入硫酸亚铁除去残留的亚氯酸盐,硫酸亚铁除可与亚氯酸钠反应外,还可以起到的作用是____________。
(7)实验室可用亚氯酸钠和氯酸钠在酸性条件下反应制备ClO2气体。写出上述反应的离子方程式为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com