
| No | 项目 | 结果 | 正常范围参考值 | 单位 |
| 1 | 红细胞计数 | 2.3 | 3.5~5 | 1×10 12/L |
| 2 | 血红蛋白 | 75 | 110~150 | g/L |
| 3 | 血小板计数 | 205.5 | 100~300 | 109/L |
| A. | 钙 | B. | 铁 | C. | 锌 | D. | 钠 |
分析 血常规化验单中有红细胞计数、血红蛋白、血小板计数,可通过与正常值对比了解患者的健康状况.由血常规检查报告单可看出红细胞数、血红蛋白比正常值低,可能患贫血.
解答 解:由血常规检查报告单可看出:红细胞计数的正常值为:3.5~5,单位为1×1012/L/L,而测定值为2.3×1012/L,此人红细胞的数量不正常,低于正常;
血红蛋白的正常值为:110~150,单位为g/L,而测定值为75g/L,此人血红蛋白的数量不正常,低于正常;
可能患贫血,需补充铁元素,由血常规检查报告单可看出红细胞数、血红蛋白比正常值低,可能患贫血,需补充铁元素,
故选B.
点评 本题考查微量元素对人体健康的重要作用,难度不大,正确解读血常规化验单是解答关键.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5L 0.1mol/L的NaCl溶液 | B. | 1L 0.2mol/L的MgCl2溶液 | ||
| C. | 1L 0.3mol/L盐酸溶液 | D. | 100mL 0.2mol/L的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

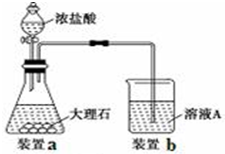

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以煤、石油和天然气为主要原料生产的合成材料是塑料、合成橡胶、合成纤维 | |
| B. | 煤是工业上获得芳香烃的一种重要来源 | |
| C. | 石油的裂解是为了提高轻质油(例如汽油)的产量 | |
| D. | 天然气的主要成分是甲烷,属于不可再生资源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
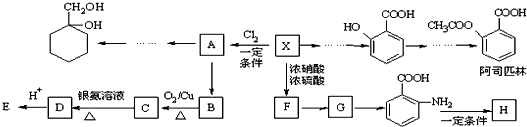
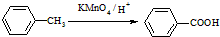
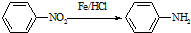 (苯胺,易被氧化)
(苯胺,易被氧化) ,F→G的反应类型是氧化反应.
,F→G的反应类型是氧化反应. .
.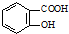 的同分异构体的结构简式
的同分异构体的结构简式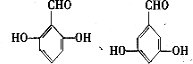 .(写出2种)
.(写出2种)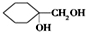 ,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:
,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com