
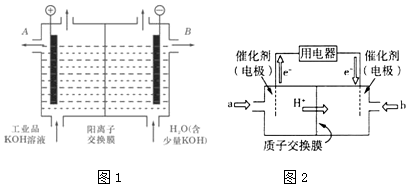
分析 (1)电解氧化铝冶炼Al;
(2)①该电解槽的阳极上氢氧根离子失去电子;
②阳离子向阴极移动,B为除去杂质的KOH;
(3)甲醇燃料电池,电解质为酸,由氢离子向正极移动可知,a为负极,甲醇失去电子;结合电极反应及转移电子计算.
解答 解:(1)工业冶炼铝的化学方程式是2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,故答案为:2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
(2)①该电解槽的阳极反应式是4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
②阳离子向阴极移动,B为除去杂质的KOH,则除去杂质后的氢氧化钾溶液从液体出口B导出,故答案为:B;
(3)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;CH3OH-6e-+H2O=CO2+6H+;
②负极反应式为CH3OH-6e-+H2O=CO2+6H+,当转移2mol电子时,左侧质量减轻$\frac{1}{6}$×2×(44-32)g=4g,还要有2molH+通过质子交换膜进入右侧,质量减少2g,正极反应式为O2+4H++4e-=2H2O,右侧质量增加32g×$\frac{1}{4}$×2=16g,加上转移过来的2gH+,因此左右两侧溶液的质量之差为16g+2g+4g+2g=24g,
故答案为:24.
点评 本题考查电化学,为高频考点,把握电解池与原电池的工作原理、电极反应为解答的关键,侧重分析与应用能力的考查,注意(3)中计算为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
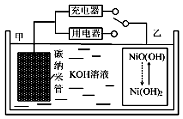 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 放电时,甲电极反应为:NiO(OH)+H2O+e?═Ni(OH)2+OH? | |
| B. | 放电时,甲电极为正极,OH?移向乙电极 | |
| C. | 电池总反应为H2+2NiO(OH)$?_{放电}^{充电}$ 2Ni(OH)2 | |
| D. | 充电时,电池的碳电极与直流电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有1molNa+ | |
| B. | 将142g Na2SO4溶于少量水后再稀释到 100mL | |
| C. | 1 mol Na2SO4溶于1 L蒸馏水中 | |
| D. | 1 L溶液中含有142 g Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法除去食盐水中的泥沙 | |
| B. | 用分液的方法分离乙醇和水的混合物 | |
| C. | 用萃取的方法提取碘水中的碘 | |
| D. | 用结晶的方法分离氯化钠和硝酸钾的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KAlSiO4 | B. | KAlSi2O6 | C. | KAlSi3O8 | D. | KAlSi4O10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、N、O元素的单质与氢气化合越来越难 | |
| B. | Li、Na、K的氧化物的水化物的碱性依次减弱 | |
| C. | Na、Mg、Al的简单离子的氧化性以依次增强 | |
| D. | P、S、Cl元素的最高正价依次升高,其对应的气态氢化物的稳定性依次减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com