
����Ŀ����������ͼ���漰��ƽ��ԭ����������أ� ��
A. ��ͼ��ʾ�����£���0.1mol?L��1��ˮ����HCl����ʱ����Һ������Ũ��������HCl�ı仯��ʵ�߱�ʾc��NH3?H2O�������߱�ʾc��NH
��ͼ��ʾ�����£���0.1mol?L��1��ˮ����HCl����ʱ����Һ������Ũ��������HCl�ı仯��ʵ�߱�ʾc��NH3?H2O�������߱�ʾc��NH ![]() ��������M��ʱ��Һ������
��������M��ʱ��Һ������
B. ��ͼ��ʾ2SO2��g��+O2��g��?2SO3��g����H��0�����淴Ӧ��ƽ�ⳣ�����¶ȵı仯
��ͼ��ʾ2SO2��g��+O2��g��?2SO3��g����H��0�����淴Ӧ��ƽ�ⳣ�����¶ȵı仯
C. ��ͼ��ʾ��Ӧ2NH3��g��?3H2��g��+N2��g�����ں��º�ѹװ���д�ƽ��ʱ��N2�����ʵ�����ͨ��NH3�����ʵ����ı仯��ϵ
��ͼ��ʾ��Ӧ2NH3��g��?3H2��g��+N2��g�����ں��º�ѹװ���д�ƽ��ʱ��N2�����ʵ�����ͨ��NH3�����ʵ����ı仯��ϵ
D. ��ͼ��ʾAgCl��s��?Ag+��aq��+Cl����aq�������ӵ�Ũ�ȹ�ϵ��������b��ʱ���������ֵ�ˮ���Ե���ƽ���ߵ�a�㴦
��ͼ��ʾAgCl��s��?Ag+��aq��+Cl����aq�������ӵ�Ũ�ȹ�ϵ��������b��ʱ���������ֵ�ˮ���Ե���ƽ���ߵ�a�㴦
���𰸡�C
���������⣺A������M��ʱ��Һ�а�ˮ��笠�����Ũ�Ⱦ�Ϊ0.05mol/L��һˮ�ϰ��ĵ���̶ȴ���笠����ӵ�ˮ��̶ȣ���Һ�Լ��ԣ���A����B����֪�÷�Ӧ������Ϊ���ȷ�Ӧ�������¶�ƽ�����ƣ�K��������С��K������ͼ����ʵ�ʲ�������B����
C�������������ʵ���ƽ�����ƣ����������ʵ�������ͼ����ʵ������ϣ���C��ȷ��
D���������ֵ�ˮ�������Ӻ�������Ũ�Ⱦ�����b�㵽a��������Ũ�Ȳ��䣬��D����
��ѡC��
�����㾫�������û�ѧƽ�ⳣ���ĺ�������������ˮ��Һ�еĵ���ƽ�����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��ָ֪��һ�������µĿ��淴Ӧ�����Ӧ���淴Ӧ��������ȣ���Ӧ������и���ֵ�Ũ�Ȳ����״̬����������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ����������;�㷺�Ľ�������ҵ�����õ�����ࣨ��Ҫ����Fe2O3��CuO��Cr2O3�������������ʣ����ս���ͭ����������ͼ�� 
��֪���������ʳ�����pH�����
Fe3+ | Cu2+ | Cr3+ | |
��ʼ����pH | 2.1 | 4.7 | 4.3 |
��ȫ����pH | 3.2 | 6.7 | a |
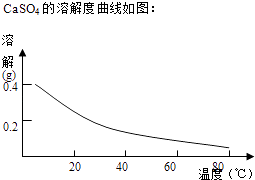
��ش��������⣺
��1����ҺI������������Ҫ�����ѧʽ����
��2���ڢڲ������У��ȼ���Ca��OH��2������Һ��pH�����ڷ�ΧΪ �� Ȼ����Һ������80����ȹ��ˣ�����������ijɷ�Ϊ ��
��3��������Ũ�ȡ�1��10��5molL��1ʱ��������Ϊ���ӳ�����ȫ���ڢܲ������У���ҪʹCr3+��ȫ����������������Һ��a����СֵΪ �� ����֪��Kap[Cr��OH��3]=6.3��10��31 �� ![]() ��4.0��lg4=0.6��
��4.0��lg4=0.6��
��4��Cr��OH��3���ȷֽ�ΪCr2O3 �� �����ȷ�����ұ����������д�����ȷ������Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӿ���Ч��ͻ����������ǣ�������ȡCu(NO3)2���˲��õķ������� ��
A. Cu��HNO3(Ũ) �� Cu(NO3)2 B. Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C. Cu��HNO3(ϡ) �� Cu(NO3)2 D. Cu��Hg(NO3)2�� Cu(NO3)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ 2 mol��L-1��Na2CO3��Һ950 mL������ʱ������ΪӦ��ѡ�õ�����ƿ�Ĺ��ͳ�ȡ��̼���������ֱ���( )
A. 950 mL��201.4 g B. 500 mL�� 286 g
C. 1000 mL��212 g D. 1000mL��201.4 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ױ���3��ͬ���칹�壬���ױ��б����ϵ�һ����ﹲ��6�֣����۵���±���
6��һ����ױ����۵�/�� | 234 | 206 | 213.8 | 204 | 214.5 | 205 |
��Ӧ���ױ����۵�/�� | 13 | ��54 | ��27 | ��54 | ��27 | ��54 |
�ɴ��ƶ��۵�Ϊ234���һ����ױ������ǣ� ��
A.
B.
C.
D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��5���ȩ�2��3�����⩁1����ͪ��һ����Ҫ��ҽҩ�м��壮��֪��R��Cl ![]() RCH��COOC2H5��2
RCH��COOC2H5��2![]() RCH2COOH
RCH2COOH
�Ի�����A������ʽΪC7H7Cl��Ϊԭ�Ϻϳ�5���ȩ�2��3�����⩁1����ͪ��������F�������������£�
A ![]() B
B ![]()

![]() D
D ![]()

![]()

��1��д��A�ṹ��ʽ �� ��ӦE��F�ķ�Ӧ���� ��
��2��������B�м�����������������ˮ��Һ���ڸ��¸�ѹ���������Ӻ��ʵĴ���������±��ԭ�Ӳ���ˮ�⣩��Ӧ�ķ���ʽ ��
��3��ij��������D��ͬ���칹�壬��ʹFeCl3��Һ����ɫ���ҷ�����ֻ��3�ֲ�ͬ��ѧ�������⣮д���û�����Ľṹ��ʽ������дһ�֣���
��4��E��F��ת���У������һ����F��Ϊͬ���칹��ĸ������ṹ��ʽΪ ��
��5����������֪ʶ����������Ϣ��д���Ի�����F��CH2��COOC2H5��2Ϊ�л���Ӧԭ���Ʊ� ![]() �ĺϳ�·������ͼ��ע����Ӧ���������ϳ�·������ͼʾ�����£� CH3CH2OH
�ĺϳ�·������ͼ��ע����Ӧ���������ϳ�·������ͼʾ�����£� CH3CH2OH ![]() CH2=CH2
CH2=CH2 ![]()
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ��һ���ܴ���������ǣ� ��
A.0.1 mol?L��1 NaOH��Һ��K+��Ba2+��Cl����HCO ![]()
B.0.1 mol?L��1 Na2CO3��Һ��K+��NH ![]() ��NO
��NO ![]() ��SO
��SO ![]()
C.0.1 mol?L��1 FeCl3��Һ��K+��Na+��I����SCN��
D.0.1 mol?L��1 HCl����Һ��Ca2+��Na+��ClO����NO ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�����Һ������������������������У���ȷ����(����)
A.���ù��˵ķ��������Ƿ���B.�������ǿ��ö����ЧӦ
C.�������ᶼ�г�������D.��������Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����X��Al2O3��Fe2O3��Cu��SiO2�е�һ�ֻ���������ɡ�ijУ������ȤС��������;���ֱ��X��������ʵ��̽���������й�˵������ȷ����
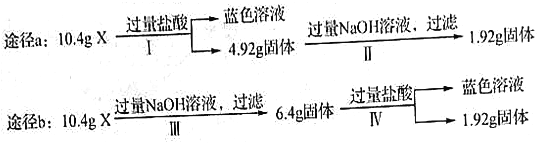
A. ��ͼ��֪X�п��ܴ���Fe2O3 B. �����жϻ�������Ƿ���Al2O3
C. 1.92g����ɷ�ΪCu D. ��ͼ���Լ���Fe2O3��Cu������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com