
【题目】下列叙述正确的是( )
A. 利用丁达尔效应可以区分溶液和胶体
B. 所有金属元素都可以用焰色反应来鉴别
C. 水泥、玻璃、光导纤维的主要成分都属于硅酸盐
D. pH值小于7的雨水称为酸雨
科目:高中化学 来源: 题型:
【题目】“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能。用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如图。下列有关说法正确的是

A. 该电池的总反应为C+O2=CO2
B. 煤直接燃烧发电比直接煤燃料电池发电的能量利用率高
C. 进入反应室的煤块粉碎成粉末状对反应速率和限度均无影响
D. 电子由电极b沿导线流向电极a,入口A加入的物质为煤粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不用其他试剂鉴别:①NaOH ②KCl ③Mg(NO3)2 ④CuSO4四种溶液,先直接鉴别出一种,再逐一鉴别其余物质,则正确的鉴别顺序是( )
A. ④①③② B. ①④③② C. ①③④② D. ④②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 皂化反应后的溶液中加饱和食盐水,析出的固体沉于底部
B. 蛋白质遇福尔马林发生变性,可以用于食品的消毒杀菌
C. 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应
D. 化合物CH2Cl2的的结构只有一种,且可继续发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
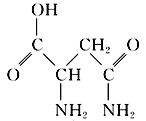
(1)天冬酰胺所含元素中,________(填元素名称,下同)元素基态原子核外未成对电子数最多,第一电离能最大的是________。
(2)天冬酰胺中碳原子的杂化轨道类型为________,分子中σ键和π键数目之比为________。
(3)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表。
化学式 | 键长/nm | 键角 |
H2O | 0.99 | 104.5° |
H2S | 1.34 | 92.3° |
H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为________________________________________。
H2O、H2S、H2Se沸点由高到低的顺序为________________,酸性由强到弱的顺序为________________。
(4)写出铬的基态原子电子排布式:________________________________________。
(5)铬为体心立方晶体,晶胞结构如图,则该晶胞中含有______个铬原子。若铬的密度为ρg·cm-3,相对原子质量为M,NA表示阿伏加德罗常数的值,则铬原子的半径为______cm。
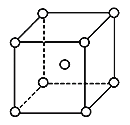
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是一种液体,易分解为水和氧气,常作氧化剂、漂白剂和消毒剂,为贮存、运输、使用的方便,工业常将H2O2转化为固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是
A.MnO2 B.H2S C.稀盐酸 D.NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①—⑩在表中的位置回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)③和⑧的最高价含氧酸的酸性强弱关系是_____________________________(用化学式填写)。
(2)⑥、⑦、⑩的简单离子的离子半径由大到小的顺序是________________(用离子符号表示)。
(3)由⑨与⑩形成的某种分子中各原子都满足最外层为8电子结构,其化学式是_________;由⑤与⑥形成的某种化合物中含有两类化学键,该化合物的电子式为___________。
(4)⑦的最高价氧化物对应水化物与⑥的最高价氧化物对应水化物反应的离子方程式为:________。
(5)⑧与⑩相比,非金属性较强的是_______(用元素符号表示),下列事实能证明这一结论的是_______(填字母序号)
a. 常温下⑧的单质呈固态,⑩的单质呈气态
b. ①与⑧和⑩形成的化合物分别为X和Y,稳定性Y>X
c. ⑧与⑩形成的化合物中⑧呈正价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E、F、D、X、Y、Z为前四周期元素,且原子序数依次增大。E的最高正价和最低负价的绝对值相等,F有三个能级,且每个能级上的电子数相等,D原子未成对电子数在同周期元素中最多,X与D同周期,第一电离能比D低,Y与F同主族,Z的最外层只有一个电子,其它电子层电子均处于饱和状态。请回答下列问题:
(1)Y原子基态核外电子排布式为__________;基态Z原子中电子占据的最高能层符号为_________。
(2)F、D、X的电负性由小到大的顺序为__________(用元素符号表示)。
(3)E、F、D、X形成的有机物FX(DE2)2中F的杂化轨道类型为____________,DX3-离子的立体构型是___________。
(4)下列关于F2E2分子和E2X2分子的说法正确的是________。
a.分子中都含σ键和π键 b.F2E2分子的沸点明显低于E2X2分子
c.都是含极性键和非极性键的非极性分子 d.互为等电子体
(5)将Z单质的粉末加入到DE3的浓溶液中,并通入X2,充分反应后溶液呈深蓝色,该反应的离子方程式为________。
(6)X和Na的一种离子化合物的晶胞结构如图,该离子化合物为_________(填化学式)。Na+的配位数为_________。晶胞有两种基本要素,一种是原子坐标参数,表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0, ![]() ),C为(
),C为(![]() ,
, ![]() ,0),则D原子的坐标参数为________。另外一种是晶胞参数,如已知该晶胞的密度为ρg cm-3,阿伏加德罗常数为NA,则两个最近的X离子间距离为________nm(用含ρ、NA的计算式表示)。
,0),则D原子的坐标参数为________。另外一种是晶胞参数,如已知该晶胞的密度为ρg cm-3,阿伏加德罗常数为NA,则两个最近的X离子间距离为________nm(用含ρ、NA的计算式表示)。
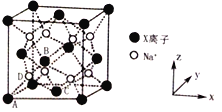
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com