
将一定质量的Mg,Zn,Al混合物与足量稀H2SO4反应,生成H22.8L(标准状况),原混合物的质量可能是
| A.2g | B.4g | C.7.8g | D.10g |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012届河北省衡水中学高三下学期二调考试理综试卷(带解析) 题型:填空题
(Ⅰ)氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应。10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为 。
(2)下图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式 。
(3)NH3(g)燃烧的方程式4NH3(g)+7O2(g)==4NO2(g)+6H2O(l),
已知:2H2(g)+O2(g)==2H2O(l) △H=" -483.6" kJ/mol
N2(g)+2O2(g)==2NO2 (g) △H="+67.8" kJ/mol
N2(g)+3H2(g)==2NH3 (g) △H="-92.0" kJ/mol
请计算NH3 (g)的燃烧热 。
| 温度[来源:学§科§网] | 平衡浓度/ (mol L-1)[来源:学*科*网Z*X*X*K] | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | | 0.1 |
 2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是
2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是 | 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 | | |
 电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
查看答案和解析>>
科目:高中化学 来源:2014届江西省高三上学期第二次月考化学试卷(解析版) 题型:实验题
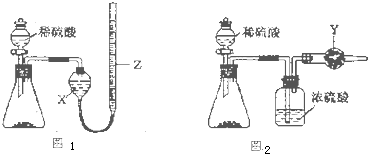
为测定Na2CO3和NaHCO3固体混合物中Na2CO3的质量分数,称取一定质量的样品,甲同学利用图I所示装置测量产生CO2的体积,乙同学利用图II所示装置通过干燥管的增重测量产生CO2的质量,已知所用稀硫酸均足量。

(l)盛放稀硫酸的仪器名称为 。
(2)试剂X为 ;试剂Y为 。
(3)甲同学在进行实验时,为减小误差,应注意的事项有(填选项字母) 。
A.读数前应使整套装置冷却至室温
B.调整Z的高度使量气装置左右液面相平
C.读数时视线与Z内凹液面最低点相切
D.读数前应通入一定量的N2使生成的CO2全部进入量气装置
(4)按乙同学的实验方案进行实验,使测得的Na2CO3的质量分数偏高的因素有(写一种)
,使测得的Na2CO3的质量分数偏低的因素有
(写一种) 。
(5)为完成相同的测定任务,下列实验方案不能达到实验目的的是 (填选项字母)。
A.取mg混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干得ng固体
B.取mg混合物与足量盐酸充分反应,将溶液加热、蒸干、灼烧得ng固体
C.取mg混合物充分加热,固体质量减少ng
D.将图II装置中的稀硫酸改为稀盐酸进行实验
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省唐山市高三4月第二次模拟理综化学试卷(解析版) 题型:实验题
为测定Na2CO3和NaHCO3固体混合物中Na2CO3的质量分数,称取一定质量的样品,甲同学利用图I所示装置测量产生CO2的体积,乙同学利用图II所示装置通过干燥管的增重测量产生CO2的质量,已知所用稀硫酸均足量。

(l)盛放稀硫酸的仪器名称为 。
(2)试剂X为____ ;试剂Y为____ 。
(3)甲同学在进行实验时,为减小误差,应注意的事项有(填选项字母) 。
A.读数前应使整套装置冷却至室温
B.调整Z的高度使量气装置左右液面相平
C.读数时视线与Z内凹液面最低点相切
D.读数前应通入一定量的N2使生成的CO2全部进入量气装置
(4)按乙同学的实验方案进行实验,使测得的Na2CO3的质量分数偏高的因素有(写一种)
,使测得的Na2CO3的质量分数偏低的因素有(写一种)________ 。
(5)为完成相同的测定任务,下列实验方案不能达到实验目的的是 (填选项字母)。
A.取mg混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干得ng固体
B.取mg混合物与足量盐酸充分反应,将溶液加热、蒸干、灼烧得ng固体
C.取mg混合物充分加热,固体质量减少ng
D.将图II装置中的稀硫酸改为稀盐酸进行实验
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省高三下学期二调考试理综试卷(解析版) 题型:填空题
(Ⅰ)氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2mol N2和8mol H2并发生反应。10min达平衡,测得氨气的浓度为0.4mol/L,此时氮气的转化率为 。
(2)下图是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式 。

(3)NH3(g)燃烧的方程式4NH3(g)+7O2(g)==4NO2(g)+6H2O(l),
已知:2H2(g)+O2(g)==2H2O(l) △H= -483.6 kJ/mol
N2(g)+2O2(g)==2NO2 (g) △H=+67.8 kJ/mol
N2(g)+3H2(g)==2NH3 (g) △H=-92.0 kJ/mol
请计算NH3 (g)的燃烧热 。
|
温度[来源:学§科§网] |
平衡浓度/ (mol L-1)[来源:学*科*网Z*X*X*K][来源:学_科_网Z_X_X_K] |
|
|
c(NH3) |
c(CO2) |
|
|
T1 |
0.1 |
|
|
T2 |
|
0.1 |
(4)将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:
H2NCOONH4(s) 2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是
2NH3(g)+CO2(g) 在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,H2NCOONH4转化的Δn(T2)=2Δn(T1)
(Ⅱ)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
|
成分 |
含量/(mg L-1) |
成分 |
含量/(mg L-1) |
|
Cl- |
18980 |
Ca2+ |
400 |
|
Na+ |
10560 |
HCO3- |
142 |
|
SO42- |
2560 |
Br- |
64 |
|
Mg2+ |
1272 |
|
|
 电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
电渗析法淡化海水示意图如下图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
(1)阳极主要电极反应式是 。
(2)在阴极附近产生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的离子方程
式是 。

(3)淡水的出口为 (填“a”、“b”或“c”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com