
| A. | 绿色化学的核心就是如何对被污染的环境进行无毒、无害化的治理 | |
| B. | 海水化学资源丰富,利用蒸馏的方法可以获得NaCl、Br2和Mg等物质 | |
| C. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| D. | 动物体内葡萄糖被氧化成H2O、CO2的同时,伴随着热能转变成化学能 |
分析 A.绿色化学的核心:利用化学原理从源头消除污染;
B.蒸馏法蒸馏法是分离和提纯彼此互相能以任意比例互溶的液体跟液体的混合物时常用的一种方法,属于物理过程,可以从海水中提盐,要从海水中提取溴、镁得经过一系列化学反应;
C.当前能源结构中,燃料的燃烧是主要的能量来源;
D.动物体内葡萄糖被氧化成H2O、CO2的同时,伴随着化学能转变成热能.
解答 解:A.绿色化学的核心:利用化学原理从源头消除污染,故A错误;
B.要从海水中提取镁和溴,需要经过化学反应,蒸馏属于物理过程,故B错误;
C.当前能源结构中,燃料的燃烧是主要的能量来源,燃烧反应为放热反应,所以人类目前所直接利用的能量大部分是由化学反应产生的,故C正确;
D.人体在运动时发生一系列的化学反应,消耗能量,如ATP与ADP的相互转化,所以人体运动所消耗的能量与化学反应有关,故D错误;
故选:C.
点评 本题考查化学反应与能量变化,熟悉生活中的能源及与人类活动有关的能量变化是解答本题的关键,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH3+Br2$\stackrel{光照}{→}$ CH3CH2Br+HBr | B. | CH2=CH2+HBr-→CH3CH2Br | ||
| C. | 2C2H2+5O2$\stackrel{点燃}{→}$ 4CO2+2H2O | D. | C4H10$\stackrel{高温}{→}$ C2H4+C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
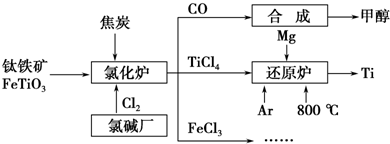
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲池中,负极反应为N2H4-4e-═4H++N2 | |
| B. | 甲池溶液pH保持不变,乙池溶液pH减小 | |
| C. | 甲池中消耗2.24LO2,此时乙池中理论上最多产生12.8g固体 | |
| D. | 反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂电极作电池负极,放电过程中发生氧化反应 | |
| B. | 1molSOCl2发生电极反应转移的电子数为2mol | |
| C. | 电池的正极反应为2SOCl2+2e-═4Cl-+S+SO2 | |
| D. | 组装该电池必须在无水、无氧的条件下进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>HI | B. | 离子半径:Na+>O2- | ||
| C. | 酸性:HClO4>H2SO4 | D. | 还原性:S2->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com