
【题目】反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势如图所示: 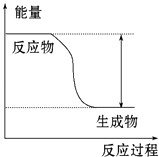
(1)该反应为反应(填“吸热”或“放热”).
(2)若要使该反应的反应速率加快,下列措施可行的是(填字母).
A.改铁片为铁粉
B.改稀硫酸为98%的浓硫酸
C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为(填“正”或“负”)极.铜片上的现象为该极上发生的电极反应为 , 外电路中电子由极(填“正”或“负”,下同)向极移动.
【答案】
(1)放热
(2)AC
(3)正;有气泡产生;2H++2e﹣=H2↑;负;正
【解析】解:(1)从图象可知,反应物总能量高于生成物总能量,所以该反应为放热反应,
所以答案是:放热;(2)A.改铁片为铁粉,增大了接触面积,反应速率增大,故A正确;
B.常温下铁在浓硫酸中钝化不能继续发生反应,故B错误;
C.升高温度,反应速率增大,故C正确,故选AC,
所以答案是:AC;(3)铜、铁、稀硫酸构成的原电池中,铁易失电子发生氧化反应而作负极,负极上电极反应式为Fe﹣2e﹣=Fe2+;铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e﹣=H2↑,铜电极上有氢气生成,所以看到的现象是铜片上有气泡产生,电子由负极流向正极;
所以答案是:正;有气泡产生;2H++2e﹣=H2↑;负;正.
【考点精析】通过灵活运用吸热反应和放热反应,掌握化学上把吸收热量的化学反应称为吸热反应;化学上把放出热量的化学反应称为放热反应即可以解答此题.


科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
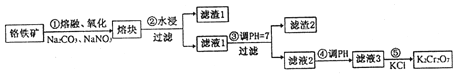
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是______。
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是______。
(2)滤渣1中含量最多的金属元素是_________,滤渣2的主要成分是________及含硅杂质。
(3)步骤④调滤液2的pH使之变______(填“大”或“小”),原因是______(用离子方程式表示)。
(4)某工厂用76 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品41.16kg,则产率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述错误的是
A.HNO3受热分解可生成NO2
B.Na在O2中燃烧可生成Na2O2
C.CaCl2暴露在空气中可生成CaCO3
D.向FeCl3溶液中滴加KSCN溶液,溶液显红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新能源是世界各国研究的共同课题。近年来,科学家正在探索铝粉作为新能源的可能性,以期望铝能成为石油的一种替代物。假如铝作为一种普遍使用的新型能源被开发利用,下列关于其有利因素的说法中,你认为错误的是( )
A. 铝质轻,便于运输、贮存且安全
B. 铝燃烧时放出的热量大,且燃烧后产物对环境的污染容易得到有效的控制
C. 在地球上,铝矿资源比较丰富
D. 现代电冶铝的工业技术已为铝作为新能源奠定了重要基础
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是_____(填字母序号)
A.Fe B.FeO C.Fe3O4 D.Fe2O3
(2)现代利用铁的氧化物循环分解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行。

①已知:Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g) ΔH1=+19.3kJ·mol-1
3FeO(s)+CO2(g) ΔH1=+19.3kJ·mol-1
3FeO(s)+H2O(g)![]() Fe3O4(s)+H2(g) ΔH2=-57.2kJ·mol-1
Fe3O4(s)+H2(g) ΔH2=-57.2kJ·mol-1
C(s)+CO2(g)![]() 2CO(g) ΔH3=+172.4kJ·mol-1
2CO(g) ΔH3=+172.4kJ·mol-1
铁氧化物循环裂解水制氢气总反应的热化学方程式是_________________。
②下图表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度(T)的变化关系。
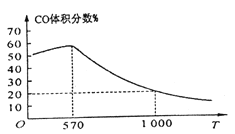
i. 当温度低于570℃时,对于反应Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g) ,温度降低,CO的转化率_____ (填“增大”、“减小”或“不变”)。
3Fe(s)+4CO2(g) ,温度降低,CO的转化率_____ (填“增大”、“减小”或“不变”)。
ii. 当温度高于570℃时,随温度升高,反应Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g)平衡常数的变化趋势是______(填“增大”、“减小”或“不变”);1000℃时,该反应的化学平衡常数的数值是__________。
3FeO(s)+CO2(g)平衡常数的变化趋势是______(填“增大”、“减小”或“不变”);1000℃时,该反应的化学平衡常数的数值是__________。
(3)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是_____________。
②基于普鲁士蓝合成原理可检测食品中CN-,方案如下:
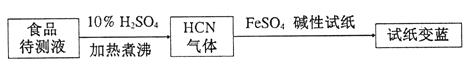
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的的是
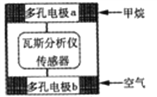
A. 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B. 电极b是正极,O2-由电极a流向电极b
C. 当固体电解质中有1 mol O2-通过时,电子转移4 mol
D. 电极a的反应式为:CH4+5O2-―8e-=CO32- +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A.2H2(g)+O2(g)═2H2O(1)△H=﹣285.8kJ/mol
B.2H2(g)+O2(g)═2H2O(1)△H=+571.6kJ/mol
C.2H2(g)+O2(g)═2H2O(g)△H=﹣571.6kJ/mol
D.H2(g)+ ![]() O2(g)═H2O(1)△H=﹣285.8kJ/mol
O2(g)═H2O(1)△H=﹣285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于炼铁和炼钢的说法中,错误的是( )
A.炼铁是铁矿石还原的过程
B.炼钢是生铁被氧化的过程
C.炼铁高炉中加入的生石灰是造渣剂
D.炼钢转炉中加入的生石灰是造渣剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com