
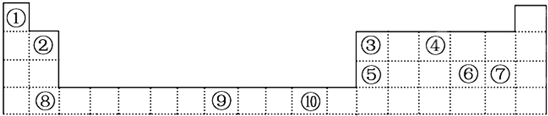
分析 由元素在周期表的位置可知,①是H,②是Be,③是B,④是N,⑤是Al,⑥是S,⑦是Cl,⑧是Ca,⑨是Fe,⑩为Cu.
(1)只有Cu的价电子为3d104s1;
(2)⑨是Fe元素,最高价离子是Fe3+,核外有23个电子;
(3)s轨道最多只能排2个电子,所以n=2,最外层电子排布式为nsnnpn+1,则该元素的最外层是2s22p3,该元素是N元素;
(4)⑥、⑦分别是S、Cl元素,①是H元素,非金属性越强,对应氢化物越稳定.
解答 解:由元素在周期表的位置可知,①是H,②是Be,③是B,④是N,⑤是Al,⑥是S,⑦是Cl,⑧是Ca,⑨是Fe,⑩为Cu.
(1)元素周期表中位于ds区的元素是第一、二副族元素,Cu的价电子为3d104s1,所以⑩位于ds区,故答案为:⑩;
(2)⑨是Fe元素,最高价离子是Fe3+,核外有23个电子,排布式为1s22s22p63s23p63d5,故答案为:1s22s22p63s23p63d5;
(3)s轨道最多只能排2个电子,所以n=2,最外层电子排布式为nsnnpn+1,则该元素的最外层是2s22p3,该元素是N元素,核外有7个电子,就有7种不同的运动状态;是上表中的④,故答案为:7;④;
(4)⑥、⑦分别是S、Cl元素,①是H元素,Cl的非金属性比S强,所以HCl比较稳定,故答案为:HCl.
点评 本题考查位置、结构与性质的应用,为高频考点,把握元素的位置、原子结构与性质为解答的关键,侧重分析与应用能力的考查,注意电子排布及元素的位置的关系,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂. ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 →
→
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性 | |
| B. | 二氧化硫的水溶液中滴加氯化钡无现象,再加入0.5 mL 3%的过氧化氢后产生沉淀 | |
| C. | 二氧化硫能漂白某些物质,说明它具有氧化性 | |
| D. | 二氧化硫漂白过的草帽过一段时间后变黄 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有8个中子的氧原子:18O | B. | Na2O的电子式: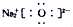 | ||
| C. | HClO 的结构式:H一CI一O | D. | F一的结构示意图: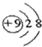 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com