
(13分)碳、硫的含量影响钢铁性能。碳、硫含量的一种测定方法是将钢样中的碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x g钢样中的碳、硫转化为CO2、SO2。
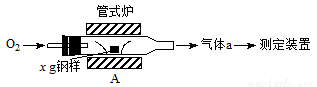
①气体a的成分是______。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2 1________+3________。
1________+3________。
(2)将气体a通入测硫装置中(如图),采用滴定法测定硫的含量。
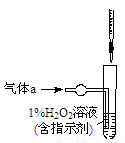
①H2O2氧化SO2的化学方程式:__________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液。若消耗1 mL NaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数:________。
(3)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:2H2(g)+O2(g)=2H2O(g) ΔH1=-d kJ·mol-1;
2C(s)+O2(g)=2CO(g) ΔH2=-e kJ·mol-1;
碳的燃烧热为f kJ·mol-1(d、e、f均大于0);
写出CO与水蒸气反应生成CO2和H2的热化学方程式:_______________________。
②将含SO2的烟气通过洗涤剂Y,再加入稀硫酸,既可以回收SO2,同时又可以得到化肥,上述洗涤剂Y可以是_______(填序号)。
a.Ca(OH)2 b.CaCl2 c.K2CO3 d.NaHSO3 e.NH3·H2O
(1)①SO2、CO2、O2(2分) ②——1Fe3O4+3SO2(2分)
(2)①H2O2+SO2=H2SO4(2分) ②(yz)/x×100%(2分)
(3)①CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=0.5d+0.5e-f kJ·mol-1(3分)
②ce(2分)
【解析】
试题分析:(1)①钢样中的碳、硫在装置A中被氧化为CO2、SO2,故a的成分为CO2、SO2以及未反应的O2;②FeS中的,-2价的硫被氧化为SO2,+2价的Fe被氧化为+3价的铁,结合所给化学计量数,可知产物应为Fe3O4和SO2,故方程式为3FeS+5O2=Fe3O4+3SO2。(2)①H2O2具有氧化性,可氧化SO2使S的化合价升高为+6价,在溶液中反应产物应为硫酸,故反应方程式为:H2O2+SO2=H2SO4;②1mL NaOH相当于yg S,故z mL NaOH相当于 zy g S,则该样品中硫的质量分数为(yz)/x×100%。(3)①碳的燃烧热化学方程式为C(s)+O2(g)=CO2(g) ΔH2=-f kJ·mol-1,根据盖斯定律,三个方程式进行加和,3式-1式÷2-2式÷2,得出ΔH=0.5d+0.5e-f kJ·mol-1,所以写热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=0.5d+0.5e-f kJ·mol-1;②碳酸钾吸收二氧化硫生成亚硫酸钾,又与硫酸反应生成二氧化硫和硫酸钾,硫酸钾可以做化肥,氨水可以吸收二氧化硫,转化为亚硫酸铵,与硫酸反应生成二氧化硫和硫酸铵,硫酸铵可以做氮肥,故选ce。
考点:本题考查碳、硫的测定原理及方法。


科目:高中化学 来源:2014-2015学年河南周口市高二上第一次月考化学(解析版) 题型:选择题
在地壳内,深度每增加1km,压强大约增加25250~30300kPa,在这样的压强下,对固体物质的平衡会发生较大的影响。如:CaAl2Si2O8+Mg2SiO4=CaMg2Al2Si3O12
(钙长石) (镁橄榄石)(钙镁)石榴子石
摩尔质量(g/mol) 278 140.6 413.6
密度(g/cm3) 2.70 3.22 3.50
在地壳区域变质的高压条件下,有利于
A.钙长石生成 B.镁橄榄石生成
C.钙长石和镁橄榄石共存 D.(钙镁)石榴子石生成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一上学期期中化学试卷(解析版) 题型:填空题
(8分)在下列反应中:
A.2F2+2H2O=4HF+O2 B.2Na+2H2O=2NaOH+H2↑
C.CaO+H2O=Ca(OH)2 D.2H2O=2H2↑+O2↑
(1)水只作氧化剂的是(填序号,下同) ,
(2)水只作还原剂的是 ,
(3)水既作氧化剂又作还原剂的是 ,
(4)水既不作氧化剂又不作还原剂的是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一上学期期中化学试卷(解析版) 题型:选择题
配制200ml0.1mol/L稀硫酸溶液时,下列实验操作使得所配溶液浓度偏小的是
A.用量筒量取所需的浓硫酸时仰视读数
B.定容后摇匀,发现液面最低点低于刻度线,再补加几滴蒸馏水至刻度线
C.定容时,俯视刻度线
D.用量筒量取浓硫酸倒入烧杯,再用蒸馏水洗量筒2~3次,洗液倒入烧杯中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一上学期期中化学试卷(解析版) 题型:选择题
关于用CCl4萃取碘水的 说法中不正确的是
A.碘在CCl4中的溶解度大于在水中的溶解度
B.萃取后水层颜色变浅
C.萃取后CCl4溶液层为紫色
D.萃取后水层颜色变红且在下层
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高二上学期第三次月考化学试卷(解析版) 题型:选择题
已知常温下AgCl的Ksp=1.8×10-10,AgI的Ksp=8.5×10-17。若在常温下,向5mL含有KCl和KI各为0.01mol/L的溶液中加入8 mL 0.01 mol/L AgNO3溶液,此时溶液中所含溶质的离子浓度大小关系正确的是
A.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-)
B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-)
D.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高二上学期第三次月考化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
C.加热0.1 mol·L-1Na2CO3溶液, 的水解程度和溶液的pH均增大
的水解程度和溶液的pH均增大
D.配制0.01 mol/L的KMnO4 消毒液,所取KMnO4样品受潮,会导致所配溶液浓度偏高
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高二上学期第一次月考化学试卷(解析版) 题型:填空题
(14分)如下图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
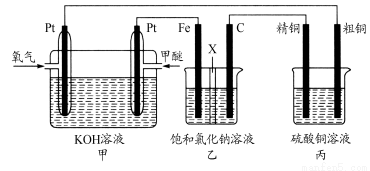
根据要求回答相关问题:
(1)通入氧气的电极为________(填“正极”或“负极”),写出负极的电极反应式_______________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________________________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________(填“铁极”或“石墨极”)区。
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为______ ___ __,反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的标况下的体积为____ ____;丙装置中阴极析出铜的质量为____ ___ _。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
A.2.7 g金属铝变为铝离子时失去的电子数为0.1NA
B.任何条件下,16gCH4与18 g H2O所含有电子数均为10NA
C.1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等
D.22.4 L的CO气体与1 mol N2所含的电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com