
已知25 ℃时KW=10-14,如果100 ℃时KW=5.5×10-13,这说明( )
A.100 ℃时水的电离程度较小
B.前者c(H+)较后者大
C.水的电离过程是一个吸热过程
D.100 ℃时0.1 mol·L-1 DCl的重水溶液中水的电离程度一定是室温时电离程度的10倍
C
【解析】由题意知,随水溶液温度的升高,KW也随之增大。即c(H+)·c(OH-)较大。c(H+)·c(OH-)较大,说明H2O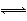 H++OH-向右进行的程度大,由此可知水的电离是吸热的。所以A、B两项错误,C项正确;当改用重水作溶剂时,由于重水的电离程度与普通水的电离程度不一定相同(事实上不同),所以室温时重水的离子积c(D+)·c(OD-)不一定等于1×10-14,也不能将普通水在100 ℃时的离子积常数应用于重水溶液,尽管DCl是强酸,在重水溶液中能够完全电离,题目告诉的浓度可以求出溶液中的c(D+),但因不知道两种温度条件下的重水离子积常数,所以无法得出c(OD-),也就是说无法知道两种温度条件下重水分子本身的电离程度,所以D项错误。
H++OH-向右进行的程度大,由此可知水的电离是吸热的。所以A、B两项错误,C项正确;当改用重水作溶剂时,由于重水的电离程度与普通水的电离程度不一定相同(事实上不同),所以室温时重水的离子积c(D+)·c(OD-)不一定等于1×10-14,也不能将普通水在100 ℃时的离子积常数应用于重水溶液,尽管DCl是强酸,在重水溶液中能够完全电离,题目告诉的浓度可以求出溶液中的c(D+),但因不知道两种温度条件下的重水离子积常数,所以无法得出c(OD-),也就是说无法知道两种温度条件下重水分子本身的电离程度,所以D项错误。


科目:高中化学 来源:2014年高二化学人教版选修四 19一次电池 二次电池练习卷(解析版) 题型:填空题
铅蓄电池是典型的可充型电池,电池总反应为:Pb+PbO2+4H++2S 2PbSO4+2H2O。
2PbSO4+2H2O。
请回答下列问题(不考虑氢、氧的氧化还原):
放电时,正极的电极反应是 ;电解液中H2SO4的浓度将变 ;当外电路通过1 mol电子时,理论上负极板的质量增加 g。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 15盐类水解的原理练习卷(解析版) 题型:填空题
(1)把NH4Cl晶体溶入水中,得到饱和NH4Cl溶液。若在该溶液中加入镁条,观察到有气泡产生,点燃有爆鸣声,此气体是 ,产生该气体的原因是 (用离子方程式表示),微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是 ,产生该气体的原因是 ,总的离子反应方程式为 。
(2)NH4Cl溶于重水后,产生的一水合氨和水合氢离子均正确的是( )
A.NH2D·H2O和D3O+B.NH3·D2O和HD2O+
C.NH3·HDO和D3O+D.NH2D·HDO和H2DO+
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 13pH的计算练习卷(解析版) 题型:填空题
一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸(用a、b、c回答)。
(1)当其物质的量浓度相同时。c(H+)由大到小的顺序是 ,pH由大到小的顺序是 。
(2)同体积、同物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是 。
(3)当c(H+)相同时,物质的量浓度由大到小的顺序为 。
(4)当pH相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 13pH的计算练习卷(解析版) 题型:选择题
某酸溶液的pH=3,则该酸溶液的物质的量浓度为( )
A.一定大于0.001 mol·L-1
B.一定等于0.001 mol·L-1
C.一定小于0.001 mol·L-1
D.以上说法均欠妥
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 12水的电离 溶液的酸碱性练习卷(解析版) 题型:选择题
室温下,某溶液中由水电离产生的c(H+)等于10-13 mol·L-1,该溶液的溶质不可能是( )
A.NaHSO4B.NaClC.HClD.Ba(OH)2
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 11弱电解质的电离练习卷(解析版) 题型:选择题
在0.1 mol·L-1的HCN溶液中存在如下电离平衡HCN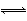 H++CN-,对该平衡,下列叙述正确的是( )
H++CN-,对该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,平衡向逆反应方向移动
C.滴加少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减少
D.加入少量NaCN固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 模块综合检测练习卷(解析版) 题型:填空题
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
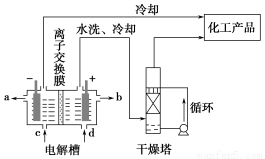
(1)上图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是________;NaOH溶液的出口为________(填字母);精制饱和食盐水的进口为________(填字母);干燥塔中应使用的液体是________。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为___________________________________。
②SiCl4可转化为SiHCl3而循环使用,一定条件下,在20 L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2和SiHCl3物质的量浓度分别为0.140 mol/L和0.020 mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为________kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0 kg,则生成氢气________m3(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 3单元综合检测练习卷(解析版) 题型:填空题
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有钙、铁、镁等离子)制备BaCl2·2H2O,工艺流程如图所示。已知常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4。
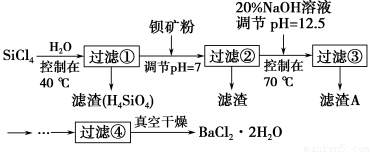
(1)SiCl4水解控制在40 ℃的原因是___________________________________。
已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) ΔH1=+47 kJ·mol-1
Si(s)+3HCl(g)=SiHCl3(s)+H2(g) ΔH2=-189 kJ·mol-1
则由SiCl4制备硅的热化学方程式为__________________________________。
(2)加钡矿粉时生成BaCl2的离子反应方程式是_________________________。
(3)加20% NaOH溶液调节pH=12.5,得到滤渣A的主要成分是________,控制温度70 ℃的目的是____________________________________________。
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到BaCl2·2H2O。实验室中蒸发浓缩,用到的含硅酸盐的仪器有__________种。
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com