
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
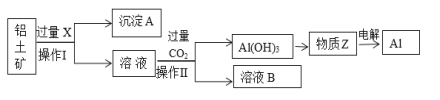
(1)操作Ⅱ的名称___________,用到的玻璃仪器有_______________。
(2)X是___________,操作Ⅱ通入过量CO2的离子方程式:____________。
(3)沉淀A的主要成分是________,溶液B中的成分为:_______________
【答案】过滤 烧杯、玻璃棒、漏斗 NaOH溶液 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Fe2O3 NaHCO3
【解析】
Al2O3、Fe2O3和硫酸反应,要将氧化铝和Fe2O3分离出来,应该选择氢氧化钠,将Al2O3溶解为可溶性的NaAlO2,则固体难溶物是Fe2O3,即试剂X为氢氧化钠,沉淀中含有Fe2O3,向NaAlO2中通足量CO2来获得Al(OH)3沉淀,发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,Al(OH)3加热分解生成Al2O3,电解熔融的Al2O3可得Al,以此解答该题。
(1)向铝土矿中加入NaOH溶液,Al2O3与NaOH溶液发生反应生成可溶性的NaAlO2和水,而Fe2O3不能反应,过滤,得到的沉淀A是Fe2O3,溶液中含有NaAlO2。过滤使用的玻璃仪器有烧杯、漏斗、玻璃棒;
(2)根据(1)可知溶液X是NaOH溶液;由于酸性H2CO3>Al(OH)3,向NaAlO2溶液中通入过量CO2气体,发生反应:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,然后过滤,得到Al(OH)3沉淀,滤液B中含有NaHCO3;所以操作Ⅱ是过滤;
(3)根据上述分析可知沉淀A是Fe2O3,溶液B中的成分为NaHCO3。


科目:高中化学 来源: 题型:
【题目】将质量相等的铁片和铜片用导线相连浸入500 mL硫酸铜溶液中构成如图1的装置:
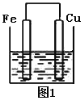
(以下均假设反应过程中溶液体积不变)。
(1)铁片上的电极反应式为______________,
(2)铜片周围溶液会出现___________的现象。
(3)若2 min后测得铁片和铜片之间的质量差为1.2 g,计算:导线中流过的电子的物质的量为__________mol;
(4)金属的电化学腐蚀的本质是形成了原电池。如下图所示,烧杯中都盛有稀硫酸。
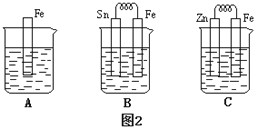
①图2 B中的Sn为________极,Sn极附近溶液的pH(填“增大”“减小”或“不变”)____。
②图2 C中被腐蚀的金属是___________。比较A、B、C中纯铁被腐蚀的速率由快到慢的顺序是______。
(5)人们应用原电池原理制作了多种电池,以满足不同的需要。燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
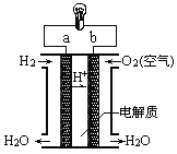
①氢氧燃料电池的正极电极反应是:___________________。电池工作一段时间后硫酸溶液的浓度_____________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
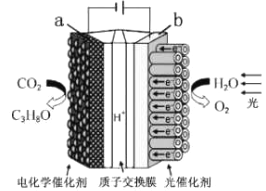
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1 mol O2,有44 gCO2被还原
D. a电极的反应为:3CO2+ 16H+-18e-= C3H8O+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
①2H2(g)+O2(g)===2H2O(l) ΔH=-570 kJ·mol-1;
②H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1;
③C(s)+1/2O2(g)===CO(g) ΔH=-110.5 kJ·mol-1;
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1;
⑤CO2(g)+2H2O(g)===2CH4(g)+2O2(g) ΔH=+890 kJ·mol-1
回答下列问题:
(1)上述反应中属于吸热反应的___________________________________________。
(2)H2的燃烧热为_______________________________________________________。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s)+H2O(g)===H2(g)+CO(g) ΔH=a kJ·mol-1;则a=________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数。( )
A. 58% B. 42% C. 36% D. 64%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制。
(1)基态硫原子价层电子的轨道表达式![]() 电子排布图
电子排布图![]() 为__,基态镍原子中核外电子占据最高能层的符号为__。
为__,基态镍原子中核外电子占据最高能层的符号为__。
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为__晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为__,写出与配体互为等电子体的阴离子__![]() 任写一种
任写一种![]() 。
。
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱__>__![]() 填化学式
填化学式![]() ,理由是__。
,理由是__。
(4)H2S的键角__填“大于”“小于”“等于”)H2O的键角,请从电负性的角度说明理由__。
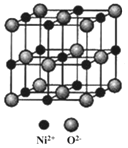
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的__空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为__g/cm3(只列出计算式![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.若温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 在元素周期表2、3、4周期中,元素
在元素周期表2、3、4周期中,元素![]() 、
、![]() 、
、![]() 、
、![]() 与元素
与元素![]() 相邻,已知:
相邻,已知:![]() 元素为磷元素;
元素为磷元素;![]() 的氯化物分子呈正四面体结构:
的氯化物分子呈正四面体结构:![]() 与
与![]() 可以形成一种高温结构陶瓷;
可以形成一种高温结构陶瓷;![]() 的最高化合价氧化物的水化物是强酸。下列选项错误的是( )
的最高化合价氧化物的水化物是强酸。下列选项错误的是( )
A.![]() 的氧化物的晶体类型是共价晶体
的氧化物的晶体类型是共价晶体
B.![]() 的单质在空气中广泛存在
的单质在空气中广泛存在
C.![]() 和
和![]() 形成的化合物中,
形成的化合物中,![]() 可以呈现的最高化合价是
可以呈现的最高化合价是![]() 价
价
D.![]() 、
、![]() 、
、![]() 的氢化物中,沸点最低的是
的氢化物中,沸点最低的是![]() 的氢化物
的氢化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com