
【题目】某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。①乙酸 ②苯酚 ③碳酸 ④乙醇
I.甲同学设计并实施了如下实验方案。
编号 | 实验操作 | 实验现象 | 结论及解释 |
1 | 分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是①③溶液 | 略 |
2 | 将CO2通入C6H5ONa溶液中 | 方程式:______________。 | |
3 | 配制等物质的量浓度的CH3COONa、 NaHCO3溶液,并比较其pH | NaHCO3溶液pH大于 CH3COONa溶液 | 略 |
4 | 向含酚酞的NaOH溶液中,各滴加等量的②④两种溶液 | ④中无明显现象 ②中红色明显变浅 | 滴加②时方程式:______。 |
结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)______________。 | |||
II.乙同学对甲同学的实验提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示。

(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)D中,B管插入__________中,C管插入_________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有________溶液的洗气装置,使乙同学的实验设计更加完善。
【答案】C6H5ONa+CO2+H2O=C6H5OH↓+NaHCO3 C6H5OH+NaOH![]() C6H5ONa+H2O ①、③、②、④ E F 饱和NaHCO3 溶液
C6H5ONa+H2O ①、③、②、④ E F 饱和NaHCO3 溶液
【解析】
I.苯酚具有弱酸性,可以和氢氧化钠反应,生成无色的苯酚钠溶液;苯酚的酸性比碳酸弱,所以将CO2通入C6H5ONa溶液中,生成苯酚;
II.根据实验目的,以及所发生的化学反应,确定实验方案的设计。
I.NaHCO3溶液pH大于等物质的量浓度的CH3COONa溶液,说明乙酸的酸性强于碳酸;苯酚钠和二氧化碳、水反应生成碳酸氢钠,苯酚的溶解性较小变为浊液,说明碳酸的酸性比苯酚强;向含酚酞的NaOH溶液中,各滴加等量的乙醇和苯酚两种溶液,乙醇与氢氧化钠不反应,所以无变化,苯酚具有酸性,和氢氧化钠反应,所以②中红色明显变浅,说明苯酚的酸性强于乙醇。由此证明酸性:乙酸>碳酸>苯酚>乙醇;酸性越强,羟基中的氢原子的活泼性越强,则四种物质中羟基中的氢原子的活泼性由强到弱的顺序是:即①、③、②、④;
故答案为:C6H5ONa+CO2+H2O=C6H5OH+NaHCO3;C6H5OH+NaOH→C6H5ONa+H2O;①、③、②、④;
II.一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验目的是证明酸性:乙酸>碳酸>苯酚.根据强酸制取弱酸的原则,须根据酸性:乙酸>碳酸>苯酚,即乙酸和碳酸钠反应生成二氧化碳(在A装置中),二氧化碳、水和苯酚钠反应生成苯酚和碳酸氢钠(在F装置中);在试管F之前增加了一个盛有饱和NaHCO3溶液的洗气装置,目的是将二氧化碳中的乙酸洗去,防止乙酸与苯酚钠反应,故若A管插入(填字母,下同)D中,则B管插入E中,C管插入F中组装实验仪器。
故答案为:E;F;饱和NaHCO3。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L0.1molL﹣1CH3COOH溶液中加入0.1molCH3COONa固体,平衡后则溶液中![]() ___(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:______
___(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:______
(2)常温下向20mL 0.1molL﹣1Na2CO3溶液中逐滴加入0.1molL﹣1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
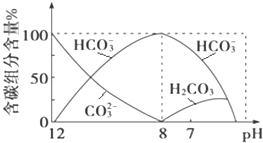
回答下列问题:
①在同一溶液中,H2CO3、HCO3﹣、CO32﹣___(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有_____、___,溶液中含量最多的三种微粒的物质的量浓度的大小关系为____;
③已知在25℃时,CO32﹣水解反应的平衡常数即水解常数Kh═2×10﹣4 molL﹣1,当溶液中c(HCO3﹣):c(CO32﹣)=2:1时,溶液的pH=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秋冬季是雾霾高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ·mol1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ·mol1
甲烷直接将NO2还原为N2的热化学方程式为_____________________________________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)ΔH<0
N2(g)+2CO2(g)ΔH<0
T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如上图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp=_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____(填“向左”、“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是__(填序号)
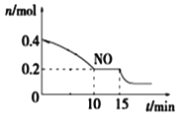
A.增大CO浓度B.升温C.减小容器体积D.加入催化剂
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2,和氮的氧化物气体(NOx),如用氢氧化钠溶液吸收可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是______溶液。
②常温下,NaHSO3显___性(填“酸”“碱”或“中”,判断的理由是(通过计算说明)_____________。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。
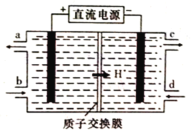
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学为了制取NO并探究其性质,进行了如下实验。

试回答下列问题:
(1)某同学用图甲装置进行实验,收集到无色气体,由此确定铜和稀硝酸反应生成NO气体。该同学的推断不合理的理由是__________ (用化学方程式表示)。
(2)另一名同学设计了图乙装置进行实验,步骤如下:①在大试管中放入适量石灰石,加入过量稀硝酸;②待石灰石反应完全,将铜丝浸入过量的稀硝酸中;③一段时间后,观察到大试管中气体始终为无色,收集反应产生的气体。其中步骤①的作用是___________。
(3)当过量的铜与稀硝酸完全反应后,再加20%的稀硫酸,铜片上又有气泡产生,稀硫酸的作用是___(填选项编号),反应的离子方程式为__________。
a.还原剂 b.氧化剂 c.提供氢离子 d.提供热能
(4)某些资料认为NO不能与Na2O2反应。有同学提出质疑,他认为NO易与O2发生反应,应该更容易被Na2O2氧化。
查阅资料:a.2NO+Na2O2=2NaNO2
b.6NaNO2+3H2SO4(稀)=3Na2SO4+2HNO3+4NO↑+2H2O
c.酸性条件下,NO能被MnO![]() 氧化成NO
氧化成NO![]()
该同学利用图中装置来探究NO与Na2O2的反应(装置可重复使用)。

①装置的连接顺序为A→_________,装置E的作用是 __________。
②充分反应后,欲检验装置D中是否生成了NaNO2,请简述实验方案_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高血脂严重影响人体徤康,化合物H是一种临床治疗高血脂症的药物。H的结构简式如图所示。
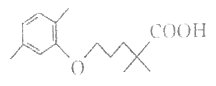
下列说法不正确的是( )
A. 有机物H含有的官能团只有羧基
B. 1mol H完全燃烧消耗19molO2
C. 有机物H是芳香化合物
D. 有机物H能和钠、碳酸氢钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语正确的是( )
A. 乙烯的结构简式:CH2CH2 B. 异丙基的结构简式:-CH(CH3)2
C. 羟基的电子式: ![]() D. 新戊烷的结构简式:
D. 新戊烷的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的甲烷燃烧产物为CO、CO2和水蒸气,此混合气体重49.6g,当其缓慢通过无水CaCl2时,CaCl2增重25.2g,则原混合气体中CO的质量为( )
A.11.2gB.13.2gC.19.7gD.24.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是
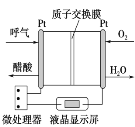
A.H+从左侧经过质子交换膜移向右侧
B.该电池的负极反应式为CH3CH2OH+3H2O-12e-===2CO2↑+12H+
C.电流由O2所在的铂电极流出
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 常温下,C(s)+H2O(g)![]() CO(g)+H2(g) 不能自发进行,则该反应的ΔH>0
CO(g)+H2(g) 不能自发进行,则该反应的ΔH>0
B. 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C. 粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
D. 常温下,在0.1 mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com