
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是
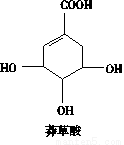
A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液中羧基和羟基均能电离出H+
 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源:2013-2014甘肃兰州一中高二下学期期末考试化学试卷(解析版) 题型:选择题
(16分)芳香族化合物A只有两个对位取代基,在一定条件下有如下图所示转化关系。其中,1 mol C与Na完全反应生成1mol H2,若1 mol C与NaHCO3完全反应,也产生1 mol气体,E可以使溴的四氯化碳溶液褪色。
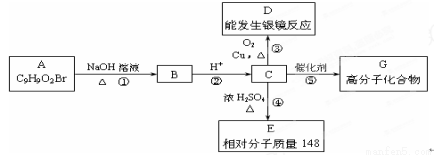
(1)③的反应类型是 ,D的结构简式是 。
(2)E中所含官能团的名称为 。
(3)写出对应的化学方程式
反应① ;
反应④ ;
反应⑤ 。
(4)现有C和E的混合物n mol,在空气中完全燃烧消耗O2 L(标准状况),若生成CO2 a L(标准状况)、H2O b g,则C、E混合物中含E的物质的量的计算式为: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃兰州一中高一下学期期末考试化学试卷(解析版) 题型:选择题
实验室可以通过乙醇分子内的脱水反应制乙烯,反应方程式如下:
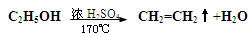
下列醇类物质中也能发生类似的脱水反应生成烯烃的是
A. B.CH3OH C.
B.CH3OH C.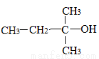 D.
D.
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃兰州一中高一下学期期末考试化学试卷(解析版) 题型:选择题
下列化学用语中表达正确的是
A.四氯化碳的电子式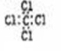 B.C2 H4的结构简式:CH2CH2
B.C2 H4的结构简式:CH2CH2
C.环已烷的结构简 D.次氯酸的结构式:H-Cl-O
D.次氯酸的结构式:H-Cl-O
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南长沙县一中、浏阳一中、宁乡一中高三5月化学试卷(解析版) 题型:填空题
(共14分)甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 |
|
|
(1)反应②是 (填“吸热”或“放热”)反应。
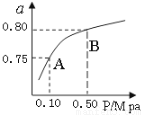
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(3)判断反应③△H 0; △S 0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正) v(逆) (填“>”“=”或“<”)
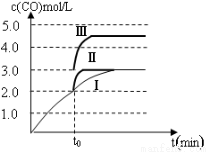
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,
将0.2 mol/L的乙酸与0.1 mol/LBa(OH)2溶液等体积混合,则混合溶液中离子浓度由大到小的顺序为
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省长沙市高三高考二模理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3 [三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型);
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长 a = cm。 (用含ρ、NA的计算式表示)

(3)下列有关的说法正确的是 。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
① Y2X2分子中Y原子轨道的杂化类型为 ,1mol Y2X2含有σ键的数目为
。
② 化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
③ 元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省长沙市高三高考二模理综化学试卷(解析版) 题型:选择题
关于下列各图的说法中,正确的是
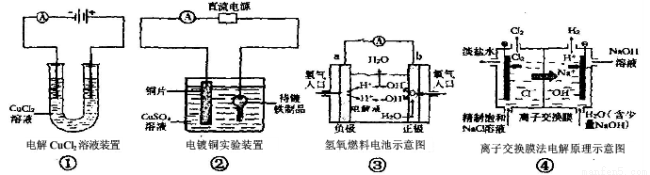
A.①中与电源负极相连的电极附近能产生使湿润淀粉KI试纸变蓝的气体
B.②中待镀铁制品应该与电源的正极相连接
C.③中的b极是电子流出的极,发生氧化反应
D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高二下学期期末考试化学试卷(解析版) 题型:选择题
天然存在的金属钫(Fr)极微量。它的21种已知同位素都有放射性。它是碱金属元素中最重的元素。根据它在周期表中的位置预言其性质,其中不正确的是( )
A.在空气中燃烧时生成氧化物Fr2O B.在已知元素中具有最大的原子半径
C.氧化物对应的水化物碱性极强 D.其单质的熔点比金属钠的熔点低
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省益阳市高二上学期期末考试化学试卷(解析版) 题型:填空题
已知有机物甲、乙、丙有如下信息:
| 甲 | 乙 | 丙 |
所含元素 | C、H | C、H、F | C、H、F |
所含电子数 | 26 | ||
结构特点 | 饱和有机物 | ||
据此推断:
(1)甲的分子式为 ,若甲分子中有2个氢原子被F原子取代,所得的有机产物可能有 种。
(2)乙是性能优良的环保产物,可代替某些破坏臭氧层的氟利昂产品用作制冷剂。其分子中C、H、F的原子个数之比为1:2:2,则乙的结构式为 。下列关于乙的叙述正确的是 。
A.其分子构型为正四面体形 B.它能使溴水褪色
C.1 mol 乙最多能与1 mol F2 发生取代反应 D.它没有同分异构体
(3)将甲、乙按物质的量之比1:1混合,所得混合物的平均摩尔质量等于丙的摩尔质量,且丙分子不存在同分异构体,则丙的分子式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com