
下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定小于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件下的ΔH不同
2HCl(g)在光照和点燃条件下的ΔH不同
科目:高中化学 来源:2015-2016学年江苏省高一下期末化学试卷(解析版) 题型:选择题
下列化学用语表示正确的是
A.硫原子的结构示意图: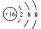
B.HCl的电子式: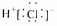
C.乙酸的结构式:C2H4O2
D.硫酸钠的电离方程式:Na2SO4=2Na++SO42-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下学期期中化学试卷(解析版) 题型:填空题
下图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。请根据装置回答下列问题:

(1)将铝片加入小试管内,然后注入足量的盐酸,有关反应的离子方程式是_____________________,试管中看到的现象是_______________________。
(2)弯管中A端液面________(填“上升”或“下降”),原因是_________________;说明此反应是________(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下学期期中化学试卷(解析版) 题型:选择题
有如下4种碳架的烃,则下列判断正确的是( )

A.a和d是同分异构体
B.b和c不是同系物
C.a和d都能发生加成反应
D.只有b和c能发生取代反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下学期期中化学试卷(解析版) 题型:选择题
化学实验必须注意安全,下列做法不存在安全隐患的是( )
A. 制取乙酸乙酯时,先将1体积的酒精倒入3体积的浓硫酸中
B. 配制银氨溶液时,将稀氨水滴加到硝酸银溶液中至白色沉淀恰好溶解为止
C. 实验室做钠与乙醇的实验时,余下的钠投入废液缸中
D. 制乙烯时,用量程为100 ℃的温度计代替量程为300 ℃的温度计,测反应液的温度
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆农业大学附中高一下学期期中化学试卷(解析版) 题型:填空题
据图回答下列问题:
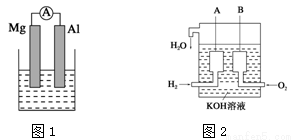
(1)若烧杯中溶液为稀硫酸,则图1装置中观察到的现象是 ;
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如上图2所示:A、B两个电极均由多孔的碳块组成。该电池中A极发生 反应(填“氧化”或“还原”);如果将上述装置中通入的H2改成甲烷(CH4),也可以组成一个原电池装置,则该电池的负极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆农业大学附中高一下学期期中化学试卷(解析版) 题型:选择题
甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,它一极通入甲醇;电解质是质子交换膜,它能传导氢离子。电池工作时,甲醇被氧化为二氧化碳和水。下列叙述中,不正确的是
A.负极的反应式为: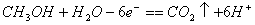
B. 氧气在电极上的反应是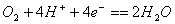
C. 通入甲醇的一极为负极,通入氧气的一极为正极
D. 燃料电池的能量转化率能达到100%
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆农业大学附中高二下学期期中化学试卷(解析版) 题型:填空题
请仔细观察下列五种装置的构造示意图,完成下列问题。
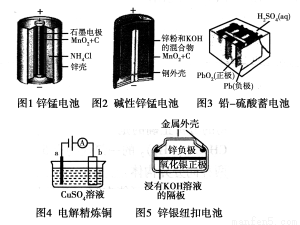
(1)锌锰电池存在自放电现象,主要原因是锌与NH4Cl反应,请结合离子方程式与文字说明原因:
。
(2)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2,则负极的电极反应式:________________。
(3)铅-硫酸蓄电池放电的总反应式:Pb+PbO2+2H2SO4=2PbSO4+2H2O,充电过程中,阳极附近c(SO42-)浓度将________(填“变大”、“变小”或“不变”),充电时阴极的电极反应式为:________________。
(4)电解精炼铜时,a极是________(填“纯铜”或“粗铜”)。锌银纽扣电池在工作过程中________(填物质名称)被还原。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期末化学试卷(解析版) 题型:填空题
在一定温度下,发生如下反应:N2(g)+3H2(g)  2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
(1) 其达到平衡状态的标志是____________________。
①氨的生成速率与氨的分解速率相等
②断开1个N≡N键的同时有6个N—H键生成
③N2、H2、NH3的体积分数不再变化
④气体的总压强不变
⑤N2、H2、NH3分子数之比为1:3:2
⑥N2、H2和NH3的浓度相等
⑦v(N2)=1/3v(H2)
⑧v正(N2)=1/3v逆(H2)
⑨混合物的密度不变
⑩混合物的平均相对分子质量不变
A.①③④⑤⑦⑩ B.①③④⑧⑩
C.①③④⑤⑧⑩ D.全部
(2)从反应开始到达到平衡用N2表示该反应的速率为: mol·L-1·min-1。
(3)平衡时H2的物质的量浓度为 mol·L-1。
(4)H2的转化率是____________。
(5)平衡时混合气体中NH3的体积分数是_______%(保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com