
【题目】铬、钼![]() 、钨
、钨![]() 都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
![]() 铬元素的最高化合价为________;基态钼原子的核外电子排布类似于基态铬原子,其原子核外有________个未成对电子。
铬元素的最高化合价为________;基态钼原子的核外电子排布类似于基态铬原子,其原子核外有________个未成对电子。
![]() 钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
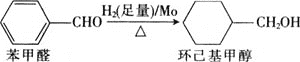
![]() 环己基甲醇分子中采取
环己基甲醇分子中采取![]() 杂化的原子是________
杂化的原子是________![]() 写元素符号
写元素符号![]() 。
。
![]() 环己基甲醇的沸点高于苯甲醛,其原因是________。
环己基甲醇的沸点高于苯甲醛,其原因是________。
![]() 铬离子
铬离子![]() 能形成多种配合物,例如
能形成多种配合物,例如![]() 。
。
![]() 已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,
已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,![]() 的配位数为________。
的配位数为________。
![]() 上述配合物中的非金属元素按电负性由小到大的顺序排列为________。
上述配合物中的非金属元素按电负性由小到大的顺序排列为________。
![]() 铬的一种氧化物的晶胞结构如图所示。
铬的一种氧化物的晶胞结构如图所示。
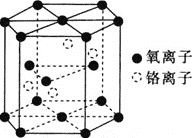
![]() 该氧化物的化学式为________。
该氧化物的化学式为________。
![]() 已知晶胞底面的边长为acm,晶胞的高为bcm,
已知晶胞底面的边长为acm,晶胞的高为bcm,![]() 代表阿伏加德罗常数的值,该铬的氧化物的摩尔质量为
代表阿伏加德罗常数的值,该铬的氧化物的摩尔质量为![]() 。该晶体的密度为________
。该晶体的密度为________![]() 用含a、b、
用含a、b、![]() 和M的代数式表示
和M的代数式表示![]() 。
。
【答案】![]() 6
6 ![]() 、O 环己基甲醇分子间能够形成氢键
、O 环己基甲醇分子间能够形成氢键 ![]()
![]()
![]()
![]()
【解析】
(1)Cr位于周期表中第4周期第ⅥB族,最高化合价为+6,基态钼原子的核外电子排布类似于基态铬原子,根据Cr的电子排布解答;
(2)①环己基甲醇分子中,C和O均满足八隅体,C和O均达到饱和;
②环己基甲醇的分子间存在氢键;
(3)①配合物的中心粒子的配位数指配位原子总数,OH-和H2O均为单齿配体,H2NCH2CH2NH2为双齿配体;
②上述配合物中,非金属元素有C、H、O、N,同周期主族元素,随着原子序数增大,电负性增大;
(4)①每个晶胞中含有![]() 数目为:4;
数目为:4;![]() 数目为:
数目为:![]() ;
;
![]() 每个晶胞的质量
每个晶胞的质量![]() ,晶胞的体积
,晶胞的体积![]() ,再结合
,再结合![]() 计算即可。
计算即可。
![]() 为24号元素,价电子排布式为
为24号元素,价电子排布式为![]() ,最高正价为
,最高正价为![]() 价;基态钼原子的核外电子排布类似于基态铬原子,价电子排布式为
价;基态钼原子的核外电子排布类似于基态铬原子,价电子排布式为![]() ,其原子核外有6个未成对电子;
,其原子核外有6个未成对电子;
![]() 环己基甲醇中C均以单键连接,采取
环己基甲醇中C均以单键连接,采取![]() 杂化,O原子的杂化轨道数为4,也采取
杂化,O原子的杂化轨道数为4,也采取![]() 杂化;
杂化;
![]() 环己基甲醇中含有羟基,分子间存在氢键,沸点较高;
环己基甲醇中含有羟基,分子间存在氢键,沸点较高;
![]() 中2个N原子均与
中2个N原子均与![]() 形成配位键,配体有3个
形成配位键,配体有3个![]() 、1个
、1个![]() 和1个
和1个![]() ,故C
,故C![]() 的配位数为6;
的配位数为6;
![]() 同周期从左到右,元素的电负性逐渐增大,氢的电负性在四种元素中最小,故电负性:
同周期从左到右,元素的电负性逐渐增大,氢的电负性在四种元素中最小,故电负性:![]() ;
;
![]() 每个晶胞中含有
每个晶胞中含有![]() 数目为:4;
数目为:4;![]() 数目为:
数目为:![]() ,故化学式为
,故化学式为![]() ;
;
![]() 每个晶胞的质量
每个晶胞的质量![]() ,晶胞的体积
,晶胞的体积![]() ,故晶胞的密度
,故晶胞的密度 。
。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.金属钠着火时,可用泡沫灭火器灭火
B.常温下,Al、Fe遇浓硫酸或浓硝酸发生钝化
C.蔗糖与银氨溶液在水浴加热条件下可发生银镜反应
D.电解精炼铜过程中,若阳极质量减少32g,则电路中转移电子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用下图所示的实验装置进行实验。

(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有________。
(2)若对调B和C装置的位置,________(填“能”或“不能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20 mol·L-1 KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0 mol·L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是________________。
②设计1号试管实验的作用是________________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为___________________________。
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为使用下图装置,加热15.0 mL饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是__________________________。(不考虑实验装置及操作失误导致不可行的原因)

(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):______________________________________________________________________。
资料:ⅰ.次氯酸会破坏酸碱指示剂;
ⅱ.次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从薄荷油中得到一种烃A(C10H16),与A相关反应如下:
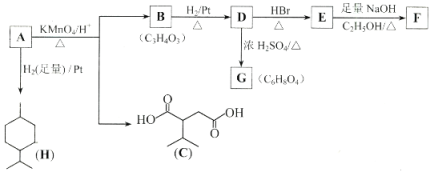
已知:
![]()
 +R
+R![]() -COOH
-COOH
![]() 所含官能团的名称为____________。
所含官能团的名称为____________。
![]() 含两个
含两个![]() 基团的C的同分异构体共有_________种
基团的C的同分异构体共有_________种![]() 不考虑手性异构
不考虑手性异构![]() ,其中核磁共振氢谱显示2个吸收峰的异构体结构简式为________。
,其中核磁共振氢谱显示2个吸收峰的异构体结构简式为________。
![]() 的反应类型为_________。
的反应类型为_________。
![]() 为含六元环的化合物,写出其结构简式________。
为含六元环的化合物,写出其结构简式________。
![]() 在一定条件下发生聚合反应可得到一种高吸水性树脂,该树脂名称为_____________。
在一定条件下发生聚合反应可得到一种高吸水性树脂,该树脂名称为_____________。
![]() 写出
写出![]() 的化学反应方程式:________________。
的化学反应方程式:________________。
![]() 参照上述合成路线,设计由苯为原料
参照上述合成路线,设计由苯为原料![]() 无机试剂任选
无机试剂任选![]() 合成己二酸的合成路线________。
合成己二酸的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葛根大豆苷元![]() 用于治疗高血压引起的头疼、突发性耳聋等症,其合成路线如下:
用于治疗高血压引起的头疼、突发性耳聋等症,其合成路线如下:
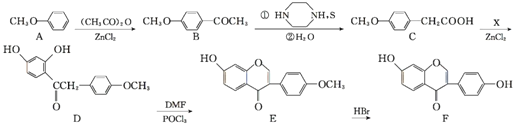
![]() 化合物B中的含氧官能团有 ______
化合物B中的含氧官能团有 ______ ![]() 填官能团名称
填官能团名称![]() ;
;
![]() 已知X为
已知X为![]() ,写出该反应的化学方程式 ______ ;
,写出该反应的化学方程式 ______ ;
![]() 已知D与
已知D与![]() 二甲基甲酰胺,结构简式为
二甲基甲酰胺,结构简式为![]()
![]() 在
在![]() 三氯氧磷
三氯氧磷![]() 的催化下反应生成E,同时还生成
的催化下反应生成E,同时还生成![]() 和另一种有机物,写出该有机物的分子式 ______ ;
和另一种有机物,写出该有机物的分子式 ______ ;
![]() 的分子式为 ______ ,由E生成F的反应类型为 ______ ;
的分子式为 ______ ,由E生成F的反应类型为 ______ ;
![]() 的芳香同分异构体中苯环上有三个取代基,并且既能发生银镜反应,又能发生水解反应的有 ______ 种,其中核磁共振氢谱为4组峰,且峰面积比为6:2:1:1的为 ______
的芳香同分异构体中苯环上有三个取代基,并且既能发生银镜反应,又能发生水解反应的有 ______ 种,其中核磁共振氢谱为4组峰,且峰面积比为6:2:1:1的为 ______ ![]() 写出其中一种的结构简式
写出其中一种的结构简式![]()
![]() 根据已有知识并结合相关信息,写出以
根据已有知识并结合相关信息,写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图
的合成路线流程图![]() 无机试剂任用
无机试剂任用![]() 合成路线流程图示例如下: ____________
合成路线流程图示例如下: ____________
![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是21世纪化学发展的主导方向。“绿色化学”要求从根本上消除污染,是一门能防止污染的科学。它包括“原料的绿色化”“化学反应的绿色化”“产物的绿色化”等内容。其中“化学反应的绿色化”要求反应物中所有的原子完全被利用且全部转入期望的产品中。下列不符合“化学反应的绿色化”的是( )
A.制![]() :
:![]()
B.制![]() :
:![]()
C.制![]() :
: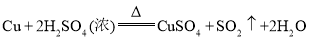
D.制聚乙烯:nCH2=CH2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2并完成相关性质探究(不考虑水蒸气)。
(1)有同学认为制得的SO2中可能混有杂质,其化学式为___和___,原因是___。
(2)为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。
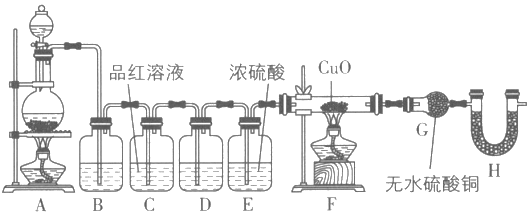
①为验证并吸收SO2,装置B中加入的试剂为___;装置C中品红溶液的作用是___。
②装置D中加入的试剂为___。
③装置G中可能出现的现象为___。
④装置H的作用为___。
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。
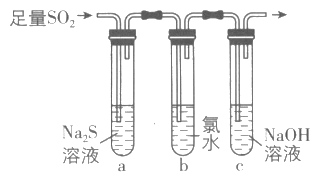
①能验证SO2具有氧化性的实验现象为___;
②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液加入品红溶液,红色褪去;
方案II:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案III:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
上述方案中合理的是___(填I、II或III);试管b中发生反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等量的N2和H2的混合气体分别充入甲、乙、丙三个容器中,进行反应![]() ,经过相同的时间后,测得反应速率分别为甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率大小关系为( )
,经过相同的时间后,测得反应速率分别为甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率大小关系为( )
A.v(甲)>v(乙)>v(丙)B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙)D.v(乙)>v(甲)>v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型含硅阻燃剂的合成路线如下。请回答相关问题:

(1)化合物A转化为B的方程式为_____,B中官能团名称是______。
(2)H的系统命名为___,H的核磁共振氢谱共有___组峰。
(3)H→I的反应类型是___
(4)D的分子式为______,反应B十I→D中Na2CO3的作用是___。
(5)F由E和环氧乙烷按物质的量之比为1:1进行合成,F的结构简式为___。
(6)D的逆合成分析中有一种前体分子C9H10O2,符合下列条件的同分异构体有___种。①核磁共振氢谱有4组峰;②能发生银镜反应;③与FeCl3发生显色反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com