
【题目】有机物M具有抗氧化、抗肿瘤作用,其结构简式如图所示。下列有关M的说法正确的是( )

A.一定条件下M可发生加成、氧化、消去等反应
B.M与Na、NaOH溶液、NaHCO3溶液均能发生反应
C.1molM与浓溴水充分反应,最多消耗Br2的物质的量为4mol
D.M分子中含有1个手性碳原子
【答案】AD
【解析】
A.M的结构中含有酚羟基、醇羟基、酯基、醚键、苯环、碳碳双键,醇羟基在一定条件下可发生氧化反应、消去反应,碳碳双键和苯环在一定条件下可发生加成反应,故A正确;
B.M的结构中含有酚羟基、醇羟基、酯基、醚键、苯环、碳碳双键,醇羟基、酚羟基可与Na反应,酯基、酚羟基可与NaOH溶液反应,酚羟基的酸性弱与碳酸,则该有机物中的官能团与NaHCO3溶液不能发生反应,故B错误;
C.M的结构中有碳碳双键与溴水反应,酚羟基的邻位和对位可与溴水反应,1molM与浓溴水充分反应,最多消耗Br2的物质的量为3mol,故C错误;
D.一个碳原子上结合四个不同的原子或原子团,该碳原子为手性碳原子,M分子中如图所示: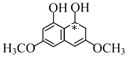 (号所示的为手性碳),含有1个手性碳原子,故D正确;
(号所示的为手性碳),含有1个手性碳原子,故D正确;
答案选AD。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在1L的密闭容器中充入2mol N2和7mol H2,发生反应N2+3H2=2NH3,保持其他条件不变,相同时间内测得NH3的浓度与温度的关系如图所示.下列叙述不正确的是
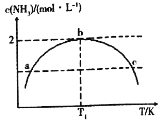
A.该反应是放热反应
B.a、c两点对应的压强 Pa<Pc
C.温度为T1时,N2的平衡转化率为50%
D.温度为T1时,再加入1mol N2和1mol NH3,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是![]()
A.60g丙醇中存在的共价键总数为10NA
B.50mL 12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3 NA
C.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数为3.75 NA
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数为3.75 NA
D.235g核素![]() 发生裂变反应:
发生裂变反应:![]() ,净产生的中子 (
,净产生的中子 (![]() )数为14 NA
)数为14 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO↑+2H2O;已知KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该反应的离子方程式;用“单线桥法”标出电子转移的方向和数目: _______________。
(2)反应中硝酸体现了_________、_________性质。
(3)反应中若转移3mol电子,则在标况下产生的气体体积是________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)____S+____NaOH![]() 2Na2S+____Na2SO3+____H2O
2Na2S+____Na2SO3+____H2O
(2)____Cl2+____Ca(OH)2![]() ____CaCl2+____Ca(ClO)2+____H2O
____CaCl2+____Ca(ClO)2+____H2O
(3)____P4+____KOH+____H2O=____K3PO4+____PH3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子方程式或离子共存的说法中正确的是![]()
A.向 ![]() 溶液中加入稀
溶液中加入稀 ![]() :
:![]()
B.![]() 溶液中加入足量
溶液中加入足量 ![]() 溶液:
溶液:![]()
C.某溶液中只存在以下 4种离子:![]() 、
、![]() 、
、![]() 、R离子
、R离子![]() 忽略微量的
忽略微量的 ![]() ,且浓度均为
,且浓度均为 ![]() ,则 R离子可能为
,则 R离子可能为 ![]()
D.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 能大量共存。
能大量共存。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Co2O3常用于作氧化剂,在生产中有重要应用。
(1)一定条件下,0.996gCo2O3与15.00mL0.1mol·L-1的Na2S2O3溶液恰好完全反应,生成Co2+和一种含硫物质,该含硫物质中硫元素的化合价是___。
(2)Co2O3、PbO2、KMnO4均可与浓盐酸反应生成Cl2,同时分别生成Co2+、Pb2+和Mn2+。若生成等物质的量的Cl2,所需Co2O3、PbO2和KMnO4的物质的量之比为___。
(3)为测定某Co2O3样品中Co2O3的纯度(杂质不参与反应),现进行如下实验:
步骤1:称取样品2.000g于锥形瓶中,加入足量硫酸和50mL0.5000mol·L-1FeSO4溶液充分反应。
步骤2:向步骤1所得溶液中逐滴滴加0.0500mol·L-1KMnO4标准溶液至终点,消耗KMnO4标准溶液的体积为20.00mL。
已知步骤1、2中所涉及物质的转化分别为:Co3+![]() Co2+、MnO
Co2+、MnO![]()
![]() Mn2+
Mn2+
通过计算确定Co2O3样品中Co2O3的质量分数___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.尿素[CO(NH2)2]是人工合成的第一种有机物。
(1)尿素中所含元素的电负性最大的是______,尿素分子间的氢键可表示为______。
(1)尿素可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
①与铁同周期且未成对电子数与Fe3+相同的元素是______。
②[Fe(H2NCONH2)6](NO3)3中存在的化学键______![]() 填序号
填序号![]() 。
。
A.离子键B.金属键C.配位键D.σ键E.π键
③![]() 中N原子杂化后的价电子排布图为______,
中N原子杂化后的价电子排布图为______,![]() 的空间构型为______。
的空间构型为______。
Ⅱ.Mg2NiH4是一种贮氢的金属氢化物
(3) Mg2NiH4可通过氢化镁和镍单质球磨制成。在Mg2NiH4晶胞中,Ni原子占据如图的顶点和面心, Mg2+处于如图八个小立方体的体心。
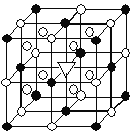
①Mg2NiH4中H的化合价为______。
②Mg2+位于Ni原子形成的______ (填“八面体空隙”或“四面体空隙”)。
③若晶体的密度为d g·cm-3,Mg2NiH4的摩尔质量为M g·mol-1,则Mg2+和Ni原子的最短距离为______nm(用含d、M的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com