
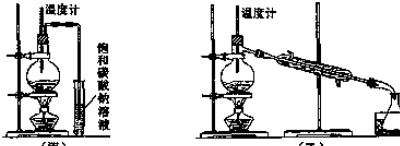
分析 (1)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚,有机化合物分子中原子或原子团被其它原子或原子团所取代的反应为取代反应;
(2)制取乙醚应有冷凝装置(防止乙醚挥发),收集装置不能离火源太近;
(3)乙醇在浓硫酸140℃的条件下生成乙醚,只有当温度计插入液面下,但不能接触瓶底,才能准确测出反应时反应液的温度,避免副反应的发生,确保产物的纯度;
(4)为了达到更好的冷凝效果,冷凝器进出水为下口进上口出,与气流逆流;用乙装置收集得到的乙醚中可能含的杂质是乙醇,除去这种杂质的试剂是饱和碳酸钠溶液,采用分液的方法分离;
(5)无水乙醇和浓硫酸共热至170℃,发生消去反应生成乙烯,在一定条件下,有机物脱去小分子生成分子中含有双键的不饱和有机物的反应属于消去反应.
解答 解:(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚,2CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O,该反应为一个乙醇分子中的乙氧基取代另一乙醇分子中的醇羟基,所以该反应属于取代反应,
故答案为:2CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O;取代反应;
(2)通过乙醚的沸点(34.6℃)以及易燃烧可以确定制取乙醚应有冷凝装置(防止乙醚挥发),收集装置不能离火源太近,否则会有危险,
故答案为:乙; 冷却效果好,产物乙醚远离火源;
(3)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚,所以反应时应迅速升温到140℃,只有当温度计插入液面下,但不能接触瓶底,才能准确测出反应时反应液的温度,避免副反应的发生,因此温度计应插入的位置是反应混合液中液面以下,但不触及瓶底,
故答案为:140;反应混合液中液面以下,但不触及瓶底;
(4)进行蒸馏实验时,为了达到更好的冷凝效果,水流方向与气流方向相反,所以冷凝器进出水为下口进上口出如下图,乙醇易挥发,所以用乙装置收集得到的乙醚中可能含的杂质是乙醇,乙醚不溶于碳酸钠溶液,除去这种杂质的试剂是饱和碳酸钠溶液,然后采用分液的方法进行分离,所以选择仪器为分液漏斗,
故答案为: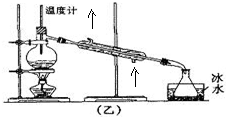 ;乙醇;饱和碳酸钠溶液;分液漏斗;
;乙醇;饱和碳酸钠溶液;分液漏斗;
(5)乙醇在浓硫酸的作用下发生分子内脱水生成乙烯,反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,乙醇发生了消去反应,所以副产物为CH2=CH2,
故答案为:消去;CH2=CH2.
点评 本题主要考查了乙醇制备乙醚,掌握相关物质的基本化学性质,是解答本题的关键,平时须注意积累相关反应知识,注意有机反应类型的判别,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(SO2)/mol•L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
| c(CO)/mol•L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
| A. | 当v(SO2)正=2v(CO)逆时,该反应达到了平衡状态 | |
| B. | X的化学式为CO2 | |
| C. | 前1s内v(X)=1.00mol•L-1•s-1 | |
| D. | 上述反应达到平衡时,CO的转化率为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用硫酸铜晶体制取氧化铜,然后利用制取的氧化铜作催化剂来使氯酸钾分解制取氧气的.回答下列问题:
利用硫酸铜晶体制取氧化铜,然后利用制取的氧化铜作催化剂来使氯酸钾分解制取氧气的.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| B. | 铜丝在氯气中燃烧:Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$Cu2++2Cl- | |
| C. | 氢氧化镁溶于盐酸:Mg(OH)2+2H+=Mg2++2H2O | |
| D. | 氯化铁溶液腐蚀铜箔制印刷线路板:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com