
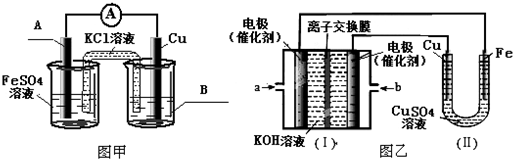
分析 (1)CuSO4溶液中铜离子能够水解生成沉淀;
(2)①铁铜原电池中Fe为负极;②铁上镀铜,铜作阳极,铁作阴极;②a为甲烷,b为氧气,据电解质溶液显碱性书写电极反应式;阳极产生的气体为氯气,其体积为448mL(标准状况下),据此计算生成NaOH的物质的量,计算pH;
(3)沉淀转移的方向是向着更难溶的方向移动,通过Ksp的大小可知那种物质更加难溶.
解答 解:(1)CuSO4溶液中铜离子能够水解生成沉淀,加入硫酸是抑制铜离子水解,离子方程式为:Cu2++2H2O?Cu(OH)2+2H+,故答案为:Cu2++2H2O?Cu(OH)2+2H+;
(2)①铁铜原电池中Fe为负极,据图中左池电解质溶液确定,左侧金属为Fe,右侧电解质溶液为CuSO4溶液,故答案为:Fe;CuSO4溶液;
②铁上镀铜,则Cu为阳极,Cu电极与b相连,b为原电池的正极,a为负极,a处通入CH4,即b处通入O2,b处电极上发生的电极反应式是:O2+4e-+2H2O=4OH-,
n(Cl2)=448÷22400=0.02(mol)
由:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH
1 2
电解产生n(OH-)=0.02mol×2=0.04mol
c(OH-)=0.04mol÷(400 mL/1000mL•L-1)=0.1mol•L-1
p(OH)=-lg0.1=1 pH=14-1=13,故答案为:CH4;O2+4e-+2H2O=4OH-;13;
(3)由于Ksp(FeS)>Ksp(CuS),所以在相同条件下CuS的溶解度更小,沉淀会向着生成CuS的方向进行,故离子方程式为FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq),故答案为:存在溶解平衡:FeS(s)?Fe2+(aq)+S2-(aq),其中的Cu2+与S2-生成了溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动.
点评 本题考查了盐类水解、电解计算、沉淀转化关系的分析等,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
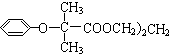
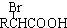 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$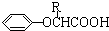
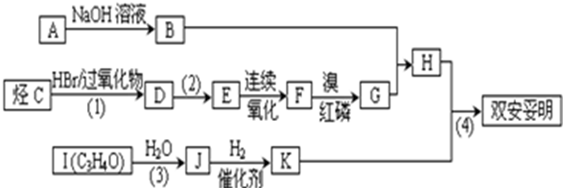
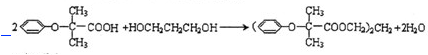
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 360 | 440 | 520 |
| K | 0.036 | 0.010 | 0.0038 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开盛装NO的集气瓶;冷却NO2气体 | |
| B. | 用冰水混合物冷却SO3气体;加热氯化铵晶体 | |
| C. | 木炭吸附NO2气体;将氯气通入品红溶液中 | |
| D. | 向酚酞溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
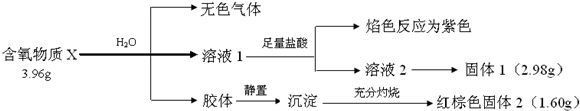
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放电时正极材料是磷酸亚铁锂(LiFePO4) | |
| B. | 放电时正极反应为:FePO4+Li++e-═LiFePO4 | |
| C. | 充电时Li+和Fe2+向阴极移动,PO43ˉ向阳极移动 | |
| D. | 充电时阴极反应为:Li++e-═Li |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素周期表中有五种元素的性质或原子结构信息如下:
元素周期表中有五种元素的性质或原子结构信息如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com