
| A. | 常温常压下,46 gN2O4中含氧原子数为2NA | |
| B. | 常温常压下,11.2 LNH3中含共价键的数目为1.5NA | |
| C. | 电解精炼铜阳极质量减少32 g时电路中转移电子总数为NA | |
| D. | 1 L 0.2 mol/LNa2SO4溶液中含有阴阳离子总数为0.6NA |
分析 A.46gNO2的物质的量为1mol,含有2mol氧原子;
B.常温常压Vm不等于22.4L/mol;
C.粗铜中含有还原性强于铜的杂质铁、锌,电解过程中优先放电;
D.1mol硫酸钠含有2mol钠离子和1mol硫酸根离子.
解答 解:A.46gNO2中含有1molNO2,含有2mol氧原子,含有氧原子数为2NA,故A正确;
B.常温常压Vm不等于22.4L/mol,无法计算氨气的物质的量,无法计算转移电子数目,故B错误;
C.电解精炼铜时,阳极粗铜中含有活泼性较强的铁、锌等杂质,电解时铁、锌杂质先放电,且铁摩尔质量小于铜的64g/mol,锌的摩尔质量大于铜的摩尔质量,所以阳极减少32g,转移的电子的物质的量不一定为NA,故C错误;
D.1 L 0.2 mol/LNa2SO4溶液含有0.4mol硫酸钠和0.2mol硫酸根离子,共含有阴阳离子总数为0.6NA,故D正确;
故选:AD.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意电解法精炼铜的原理,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 每消耗1molCH4可以向外电路提供4mole- | |
| B. | 在负极上O2获得电子,电极反应式为 O2+2H2O+4e-=4OH- | |
| C. | 外电路电子由负极流向正极,内电路电子由正极流向负极 | |
| D. | 电池放电过程中,溶液的PH不断降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1氯化钠溶液 | B. | 75 mL 2 mol•L-1氯化铵溶液 | ||
| C. | 150 mL 1 mol•L-1氯化钾溶液 | D. | 75 mL 1 mol•L-1氯化铝溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测0.1 mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 将Na块放入水中,产生气体:2Na+2H2O═2NaOH+H2↑ | |
| C. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2═Cu2++2Cl- | |
| D. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 | |
| B. | 常温常压下,5.6g乙烯与丁烯(C4H8)的混合物中氢原子数为0.8NA | |
| C. | 标准状况下,4.48 LCl2与足量的Fe反应转移电子数为0.4NA | |
| D. | 0.1 mol H218O与D2O的混合物中中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下将pH=12的氨水加水稀释,稀释过程中溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 同浓度的醋酸钠和醋酸等体积混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 25℃相同pH的①CH3COONa②NaHCO3③NaAlO2三种溶液中的c(Na+):①>②>③ | |
| D. | 浓度均为0.1mol•L-1的KHS和HCl等体积混合液中:c(HS-)+c(H2S)=0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
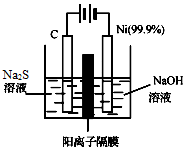 硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题:
硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥⑦ | B. | ③⑥⑦ | C. | ③⑦ | D. | ④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液中:Al3+、K+、SO42-、HCO3- | |
| B. | FeCl2溶液中:SO42-、H+、MnO4-、Na+ | |
| C. | 水电离的c (H+)=1×10-13 mol•L-1:S2-、SO32-、S2O32-、SO42- | |
| D. | 滴加甲基橙试剂显红色的溶液中:Na+、NH4+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com