
”¾ĢāÄæ”æŅŃÖŖĻĀĮŠŹż¾Ż£ŗ
ѧɜŌŚŹµŃéŹŅÖĘČ”ŅŅĖįŅŅõ„µÄÖ÷ŅŖ²½ÖčČēĻĀ£ŗ
¢ŁŌŚ30 mLµÄ“óŹŌ¹ÜAÖŠ°“Ģå»ż±Č1”Ć4”Ć4µÄ±ČĄżÅäÖĘÅØĮņĖį”¢ŅŅ“¼ŗĶŅŅĖįµÄ»ģŗĻČÜŅŗ£»
¢Ś°“ĻĀĶ¼Į¬½ÓŗĆ×°ÖĆ(×°ÖĆĘųĆÜŠŌĮ¼ŗĆ)£¬ÓĆŠ”»š¾łŌȵŲ¼ÓČČ×°ÓŠ»ģŗĻČÜŅŗµÄ“óŹŌ¹Ü5”«10 min£»

¢Ū“żŹŌ¹ÜBŹÕ¼Æµ½Ņ»¶ØĮæµÄ²śĪļŗóĶ£Ö¹¼ÓČČ£¬³·Č„ŹŌ¹ÜB²¢ÓĆĮ¦Õńµ“£¬Č»ŗó¾²ÖĆ“ż·Ö²ć£»
¢Ü·ÖĄė³öŅŅĖįŅŅõ„²ć”¢Ļ“µÓ”¢øÉŌļ”£
Ēėøł¾ŻĢāÄæŅŖĒó»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ÅäÖĘøĆ»ģŗĻČÜŅŗµÄÖ÷ŅŖ²Ł×÷²½ÖčĪŖ_______________________”£
£Ø2£©ÉĻŹöŹµŃéÖŠ±„ŗĶĢ¼ĖįÄĘČÜŅŗµÄ×÷ÓĆŹĒ(Ģī×ÖÄø)__________ __________”£
A£®ÖŠŗĶŅŅĖįŗĶŅŅ“¼
B£®ÖŠŗĶŅŅĖį²¢ĪüŹÕ²æ·ÖŅŅ“¼
C£®ŅŅĖįŅŅõ„ŌŚ±„ŗĶĢ¼ĖįÄĘČÜŅŗÖŠµÄČܽā¶Č±ČŌŚĖ®ÖŠøüŠ”£¬ÓŠĄūÓŚ·Ö²ćĪö³ö
D£®¼ÓĖŁõ„µÄÉś³É£¬ĢįøßĘä²śĀŹ
£Ø3£©²½Öč¢ŚÖŠŠčŅŖŠ”»š¾łŌČ¼ÓČČ²Ł×÷£¬ĘäÖ÷ŅŖĄķÓÉŹĒ________________________”£
£Ø4£©·ÖĄė³öŅŅĖįŅŅõ„ŗó£¬ĪŖĮĖøÉŌļŅŅĖįŅŅõ„æÉŃ”ÓƵÄøÉŌļ¼ĮĪŖ(Ģī×ÖÄø)______”£
A£®P2O5 B£®ĪŽĖ®Na2SO4
C£®¼īŹÆ»Ņ D£®NaOH¹ĢĢå
£Ø5£©ÅØĮņĖįµÄ×÷ÓĆŹĒ£ŗ¢Ł £»¢Ś ”£
£Ø6£©×°ÖĆÖŠĶØÕōĘųµÄµ¼¹ÜŅŖ²åŌŚ±„ŗĶĢ¼ĖįÄĘČÜŅŗµÄŅŗĆęÉĻ£¬²»ÄܲåČėČÜŅŗÖŠ£¬ÄæµÄŹĒ·ĄÖ¹ ”£
£Ø7£©ČōŅŖ°ŃÖʵƵÄŅŅĖįŅŅõ„·ÖĄė³öĄ“£¬Ó¦²ÉÓƵďµŃé²Ł×÷ŹĒ ”£
£Ø8£©Ä³Ķ¬Ń§½«ŹÕ¼Æµ½µÄŅŅĖįŅŅõ„µĪČė±„ŗĶNaHCO3ČÜŅŗÖŠ£¬¹Ū²ģµ½ÓŠÉŁĮæĘųÅŻ²śÉś£¬æÉµĆ³öµÄ½įĀŪŹĒ £¬øĆ¹ż³ĢÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ ”£
”¾“š°ø”æ
£Ø1£©ŌŚ“óŹŌ¹ÜÖŠĻČ¼Ó4 mLŅŅ“¼£¬ŌŁ»ŗĀż¼ÓČė1 mLÅØH2SO4£¬±ß¼Ó±ßÕńµ“£¬“żĄäÖĮŹŅĪĀŗó£¬ŌŁ¼Ó4 mLŅŅĖį²¢Ņ”ŌČ£»
£Ø2£©BC
£Ø3£©·ĄÖ¹·“Ó¦ĪļĖęÉś³ÉĪļŅ»Ęš“óĮæ±»Õō³öĄ“£¬µ¼ÖĀŌĮĻĖšŹ§£¬¼°·¢Éśø±·“Ó¦
£Ø4£©B
£Ø5£©“ß»Æ×÷ÓĆ£»ĪüĖ®×÷ÓĆ
£Ø6£©µ¹Īü
£Ø7£©ÓƱ„ŗĶĢ¼ĖįÄĘČÜŅŗ³Š½ÓÕōĮó³öµÄŅŅĖįŅŅõ„£¬ŌŁ·ÖŅŗ
£Ø8£©ŅŅĖįŅŅõ„ÖŠŗ¬ÓŠŅŅĖį£¬CH3COOH+NaHCO3=CH3COONa+CO2”ü+H2O
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©ÅØĮņĖįĆܶȓóÓŚĖ®£¬ĒŅČÜÓŚĖ®·Å³ö“óĮæČČ£¬Ó¦øĆ½«ÅØĮņĖį¼ÓČėŅŅ“¼ÖŠ£¬ÕżČ·²Ł×÷·½·ØĪŖ£ŗ½«ÅØH2SO4¼ÓČėŅŅ“¼ÖŠ£¬±ß¼Ó±ßÕńµ“£¬Č»ŗóŌŁ¼ÓČėŅŅĖį£»£Ø2£©ÖʱøŅŅĖįŅŅõ„Ź±³£ÓƱ„ŗĶĢ¼ĖįÄĘČÜŅŗĪüŹÕŅŅĖįŅŅõ„£¬ÄæµÄŹĒ³żČ„ŅŅ“¼ŗĶŅŅĖį”¢½µµĶŅŅĖįŅŅõ„µÄČܽā¶Č£¬±ćÓŚ·Ö²ć”£¹ŹŃ”BC£»£Ø3£©ŅŅ“¼”¢ŅŅĖįµÄ·Šµć½ĻµĶ£¬ĪŖ·ĄÖ¹ŅŅ“¼”¢ŅŅĖį»Ó·¢£¬Ó¦Š”»š¼ÓČČ£¬·ńŌņŅ×Ōģ³ÉŌĮĻµÄĖšŹ§”£¹Ź“š°øĪŖ£ŗ·“Ó¦ĪļÖŠŅŅ“¼”¢ŅŅĖįµÄ·Šµć½ĻµĶ£¬ČōÓĆ“ó»š¼ÓČČ£¬“óĮæ·“Ó¦ĪļĖę²śĪļÕō·¢¶ųĖšŹ§ŌĮĻ£¬ĪĀ¶Č¹żøß»¹æÉÄÜ·¢ÉśĘäĖūø±·“Ó¦£»£Ø4£©ĪŽĖ®ĮņĖįÄĘĪüĖ®ŠĪ³ÉĮņĖįÄĘ½į¾§Ė®ŗĻĪļ£»²»ÄÜŃ”ŌńP2O5”¢¼īŹÆ»ŅŗĶNaOHµČ¹ĢĢåøÉŌļ¼Į£¬ŅŌ·ĄŅŅĖįŅŅõ„ŌŚĖįŠŌ£ØP2O5ÓöĖ®Éś³ÉĖį£©»ņ¼īŠŌĢõ¼žĻĀĖ®½ā£¬¹ŹŃ”B”££Ø5£©ÅØĮņĖįŌŚõ„»Æ·“Ó¦ÖŠµÄ×÷ÓĆĪŖ“ß»Æ×÷ÓĆŗĶĪüĖ®×÷ÓĆ”££Ø6£©µ¼¹Ü²»ÄܲåČėŅŗĆęŅŌĻĀŹĒĪŖĮĖ·ĄÖ¹µ¹Īü”££Ø7£©ÓƱ„ŗĶĢ¼ĖįÄĘČÜŅŗ³Š½ÓÕōĮó³öµÄŅŅĖįŅŅõ„£¬·“Ó¦µōŅŅĖį£¬ČܽāŅŅ“¼£¬ŌŁ·ÖŅŗ”££Ø8£©ŅŅĖįŗĶĢ¼ĖįÄĘ·“Ӧɜ³É¶žŃõ»ÆĢ¼£¬·½³ĢŹ½ĪŖ£ŗ CH3COOH+NaHCO3=CH3COONa+CO2”ü+H2O£Ø


 Ķ¬²½Į·Ļ°Ēæ»ÆĶŲÕ¹ĻµĮŠ“š°ø
Ķ¬²½Į·Ļ°Ēæ»ÆĶŲÕ¹ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃõ»Æ»¹Ō·“Ó¦ÖŠŹµ¼ŹÉĻ°üŗ¬Ńõ»ÆŗĶ»¹ŌĮ½øö¹ż³Ģ”£ĻĀĆęŹĒŅ»øö»¹Ō¹ż³ĢµÄ·“Ó¦Ź½£ŗNO3-+4H++3e-ØTNO”ü+2H2O£¬KMnO4”¢Na2CO3”¢Cu2O”¢Fe2(SO4)3ĖÄÖÖĪļÖŹÖŠµÄŅ»ÖÖĪļÖŹ(¼×)ÄÜŹ¹ÉĻŹö»¹Ō¹ż³Ģ·¢Éś”£
£Ø1£©Š“³öøĆŃõ»Æ»¹Ō·“Ó¦µÄ»Æѧ·½³ĢŹ½__________________________________£»
£Ø2£©·“Ó¦ÖŠĻõĖįĢåĻÖĮĖ__________”¢______£»
£Ø3£©·“Ó¦ÖŠČō²śÉś±ź×¼×“æöĻĀ11.2LĘųĢ壬Ōņ×ŖŅʵē×ÓµÄĪļÖŹµÄĮæŹĒ__________£»
£Ø4£©ĻÖ³ĘČ”ŗ¬ÓŠŌÓÖŹµÄ¼×ѳʷ(ŌÓÖŹÓėĖį²»·“Ó¦)5.4g£¬Ē”ŗĆÓė100mL 1.4mol/LµÄĻõĖįČÜŅŗĶźČ«·“Ó¦£¬ŌņøĆѳʷµÄ“æ¶ČĪŖ__________£»
£Ø5£©Čō1mol¼×ÓėijÅضČĻõĖį·“Ó¦Ź±£¬±»»¹ŌĻõĖįµÄĪļÖŹµÄĮæŌö¼Ó£¬ŌŅņŹĒ_____________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČā¹šĖįŅģĪģõ„G(![]() )ŹĒŅ»ÖÖĻćĮĻ,Ņ»ÖÖŗĻ³ÉĀ·ĻßČēĻĀ:
)ŹĒŅ»ÖÖĻćĮĻ,Ņ»ÖÖŗĻ³ÉĀ·ĻßČēĻĀ:
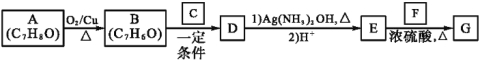
ŅŃÖŖŅŌĻĀŠÅĻ¢:
¢ŁRCHO+R'CH2CHO![]()
![]() ;
;
¢ŚCĪŖ¼×Č©µÄĶ¬ĻµĪļ,ĻąĶ¬Ģõ¼žĻĀĘäÕōĘųÓėĒāĘųµÄĆܶȱČĪŖ22”£
»Ų“šĻĀĮŠĪŹĢā:
£Ø1£©AµÄ»ÆѧĆū³ĘĪŖ ”£
£Ø2£©BŗĶC·“Ӧɜ³ÉDµÄ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø3£©FÖŠŗ¬ÓŠ¹ŁÄÜĶŵÄĆū³ĘĪŖ ”£
£Ø4£©EŗĶF·“Ӧɜ³ÉGµÄ»Æѧ·½³ĢŹ½ĪŖ ,·“Ó¦ĄąŠĶĪŖ ”£
£Ø5£©FµÄĶ¬·ÖŅģ¹¹ĢåÖŠ²»ÄÜÓė½šŹōÄĘ·“Ӧɜ³ÉĒāĘųµÄ¹²ÓŠ ÖÖ(²»æ¼ĀĒĮ¢ĢåŅģ¹¹),ĘäÖŠŗĖ“Ź²ÕńĒāĘ×Ö»ÓŠĮ½×é·å,ĒŅ·åĆ껿±ČĪŖ3”Ć1µÄĪŖ (Š“½į¹¹¼ņŹ½)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij»ÆŗĻĪļ6.4gŌŚŃõĘųÖŠĶźČ«Č¼ÉÕ£¬Ö»Éś³É8.8gCO2ŗĶ7.2gH2O”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ( )
A. øĆ»ÆŗĻĪļ½öŗ¬Ģ¼”¢ĒāĮ½ÖÖŌŖĖŲ
B. øĆ»ÆŗĻĪļÖŠĢ¼”¢ĒāŌ×ÓøöŹż±ČĪŖ1:2
C. ĪŽ·ØČ·¶ØøĆ»ÆŗĻĪļŹĒ·ńŗ¬ÓŠŃõŌŖĖŲ
D. øĆ»ÆŗĻĪļÖŠŅ»¶Øŗ¬ÓŠŃõŌŖĖŲ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗ£Ńó׏Ō“µÄĄūÓĆ¾ßÓŠ¹ćĄ«Ē°¾°£®
£Ø1£©ČēĶ¼ŹĒ“Óŗ£Ė®ÖŠĢįČ”Ć¾µÄ¼ņµ„Į÷³Ģ£®
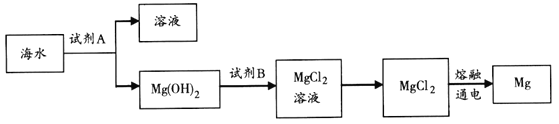
¢Ł¹¤ŅµÉĻ³£ÓĆÓŚ³ĮµķMg2+µÄŹŌ¼ĮAŹĒ________£¬Mg(OH)2×Ŗ»ÆĪŖMgCl2µÄĄė×Ó·½³ĢŹ½ŹĒ_______£®
¢ŚÓÉĪŽĖ®MgCl2ÖĘČ”MgµÄ»Æѧ·½³ĢŹ½ŹĒ________£®
£Ø2£©ŗ£“ų»ŅÖŠø»ŗ¬ŅŌI©ŠĪŹ½“ęŌŚµÄµāŌŖĖŲ£®ŹµŃéŹŅĢįČ”I2µÄĶ¾¾¶ČēĻĀĖłŹ¾£ŗ
![]()
¢Ł×ĘÉÕŗ£“ųÖĮ»Ņ½żŹ±ĖłÓƵÄÖ÷ŅŖŅĒĘ÷Ćū³ĘŹĒ________£®
¢ŚĻņĖį»ÆµÄĀĖŅŗÖŠ¼Ó¹żŃõ»ÆĒāČÜŅŗ£¬Š“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½________£®
¢Ū·“Ó¦½įŹųŗ󣬼ÓČėCCl4×÷ŻĶČ”¼Į£¬²ÉÓĆŻĶČ”©·ÖŅŗµÄ·½·Ø“ÓµāĖ®ÖŠĢįČ”µā£¬Ö÷ŅŖ²Ł×÷²½ÖčČēĶ¼£ŗ
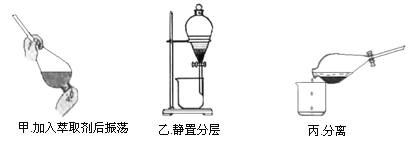
¼×”¢ŅŅ”¢±ū3²½ŹµŃé²Ł×÷ÖŠ£¬²»ÕżČ·µÄŹĒ________£ØĢī”°¼×”±”¢”°ŅŅ”±»ņ”°±ū”±£©£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŖĖŲøõ(Cr)ŌŚČÜŅŗÖŠÖ÷ŅŖŅŌCr3+(Ą¶×ĻÉ«)”¢Cr(OH)4(ĀĢÉ«)”¢Cr2O72(³ČŗģÉ«)”¢CrO42(»ĘÉ«)µČŠĪŹ½“ęŌŚ£¬Cr(OH)3ĪŖÄŃČÜÓŚĖ®µÄ»ŅĄ¶É«¹ĢĢ壬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Cr3+ÓėAl3+µÄ»ÆѧŠŌÖŹĻąĖĘ”£ŌŚCr2(SO4)3ČÜŅŗÖŠÖšµĪ¼ÓČėNaOHČÜŅŗÖ±ÖĮ¹żĮ棬æɹŪ²ģµ½µÄĻÖĻóŹĒ_________”£
£Ø2£©CrO42ŗĶCr2O72ŌŚČÜŅŗÖŠæÉĻą»„×Ŗ»Æ”£ŹŅĪĀĻĀ£¬³õŹ¼ÅضČĪŖ1.0 mol![]() L1µÄNa2CrO4ČÜŅŗÖŠc(Cr2O72)Ėęc(H+)µÄ±ä»ÆČēĶ¼ĖłŹ¾”£
L1µÄNa2CrO4ČÜŅŗÖŠc(Cr2O72)Ėęc(H+)µÄ±ä»ÆČēĶ¼ĖłŹ¾”£

¢ŁÓĆĄė×Ó·½³ĢŹ½±ķŹ¾Na2CrO4ČÜŅŗÖŠµÄ×Ŗ»Æ·“Ó¦____________”£
¢ŚÓÉĶ¼æÉÖŖ£¬ČÜŅŗĖįŠŌŌö“ó£¬CrO42µÄĘ½ŗā×Ŗ»ÆĀŹ__________(Ģī”°Ōö“ó”±”°¼õŠ””±»ņ”°²»±ä”±)”£øł¾ŻAµćŹż¾Ż£¬¼ĘĖć³öøĆ×Ŗ»Æ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ__________”£
¢ŪÉżøßĪĀ¶Č£¬ČÜŅŗÖŠCrO42µÄĘ½ŗā×Ŗ»ÆĀŹ¼õŠ”£¬ŌņøĆ·“Ó¦µÄ¦¤H______0(Ģī”°“óÓŚ”±”°Š”ÓŚ”±»ņ”°µČÓŚ”±)”£
£Ø3£©ŌŚ»Æѧ·ÖĪöÖŠ²ÉÓĆK2CrO4ĪŖÖøŹ¾¼Į£¬ŅŌAgNO3±ź×¼ČÜŅŗµĪ¶ØČÜŅŗÖŠCl£¬ĄūÓĆAg+ÓėCrO42Éś³ÉשŗģÉ«³Įµķ£¬ÖøŹ¾µ½“ļµĪ¶ØÖÕµć”£µ±ČÜŅŗÖŠClĒ”ŗĆ³ĮµķĶźČ«(ÅØ¶ČµČÓŚ1.0”Į105 mol”¤L1)Ź±£¬ČÜŅŗÖŠc(Ag+)ĪŖ_______ mol![]() L1£¬“ĖŹ±ČÜŅŗÖŠc(CrO42)µČÓŚ__________ mol
L1£¬“ĖŹ±ČÜŅŗÖŠc(CrO42)µČÓŚ__________ mol![]() L1”£(ŅŃÖŖAg2CrO4”¢AgClµÄKsp·Ö±šĪŖ2.0”Į1012ŗĶ2.0”Į1010)”£
L1”£(ŅŃÖŖAg2CrO4”¢AgClµÄKsp·Ö±šĪŖ2.0”Į1012ŗĶ2.0”Į1010)”£
£Ø4£©+6¼ŪøõµÄ»ÆŗĻĪļ¶¾ŠŌ½Ļ“󣬳£ÓĆNaHSO3½«·ĻŅŗÖŠµÄCr2O72»¹Ō³ÉCr3+£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ[»Æѧ”Ŗ”ŖŃ”ŠŽ2£ŗ»ÆѧÓė¼¼Źõ]øßĆĢĖį¼Ų£ØKMnO4£©ŹĒŅ»ÖÖ³£ÓĆŃõ»Æ¼Į£¬Ö÷ŅŖÓĆÓŚ»Æ¹¤”¢·ĄøƼ°ÖĘŅ©¹¤ŅµµČ”£ŅŌČķĆĢæó£ØÖ÷ŅŖ³É·ÖĪŖMnO2£©ĪŖŌĮĻÉś²śøßĆĢĖį¼ŲµÄ¹¤ŅÕĀ·ĻßČēĻĀ£ŗ

»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŌĮĻČķĆĢæóÓėĒāŃõ»Æ¼Ų°“1”Ć1µÄ±ČĄżŌŚ”°ŗę³“¹ų”±ÖŠ»ģÅ䣬»ģÅäĒ°Ó¦½«ČķĆĢæó·ŪĖ飬Ęä×÷ÓĆŹĒ ”£
£Ø2£©”°Ę½ĀÆ”±ÖŠ·¢ÉśµÄ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø3£©”°Ę½ĀÆ”±ÖŠŠčŅŖ¼ÓŃ¹£¬ĘäÄæµÄŹĒ ”£
£Ø4£©½«K2MnO4×Ŗ»ÆĪŖKMnO4µÄÉś²śÓŠĮ½ÖÖ¹¤ŅÕ”£
¢Ł”°![]() Ęē»Æ·Ø”±ŹĒ“«Ķ³¹¤ŅÕ£¬¼“ŌŚK2MnO4ČÜŅŗÖŠĶØČėCO2ĘųĢ壬Ź¹ĢåĻµ³ŹÖŠŠŌ»ņČõĖįŠŌ£¬K2MnO4·¢ÉśĘē»Æ·“Ó¦£¬·“Ó¦ÖŠÉś³ÉK2MnO4”¢MnO2ŗĶ £ØŠ“»ÆѧŹ½£©”£
Ęē»Æ·Ø”±ŹĒ“«Ķ³¹¤ŅÕ£¬¼“ŌŚK2MnO4ČÜŅŗÖŠĶØČėCO2ĘųĢ壬Ź¹ĢåĻµ³ŹÖŠŠŌ»ņČõĖįŠŌ£¬K2MnO4·¢ÉśĘē»Æ·“Ó¦£¬·“Ó¦ÖŠÉś³ÉK2MnO4”¢MnO2ŗĶ £ØŠ“»ÆѧŹ½£©”£
¢Ś”°µē½ā·Ø”±ĪŖĻÖ“ś¹¤ŅÕ£¬¼“µē½āK2MnO4Ė®ČÜŅŗ£¬µē½ā²ŪÖŠŃō¼«·¢ÉśµÄµē¼«·“Ó¦ĪŖ £¬Ņõ¼«ŅŻ³öµÄĘųĢåŹĒ ”£
¢Ū”°µē½ā·Ø”±ŗĶ”°![]() Ęē»Æ·Ø”±ÖŠ£¬K2MnO4µÄĄķĀŪĄūÓĆĀŹÖ®±ČĪŖ ”£
Ęē»Æ·Ø”±ÖŠ£¬K2MnO4µÄĄķĀŪĄūÓĆĀŹÖ®±ČĪŖ ”£
£Ø5£©øßĆĢĖį¼Ų“æ¶ČµÄ²ā¶Ø£ŗ³ĘČ”1.0800 gѳʷ£¬Čܽāŗó¶ØČŻÓŚ100 mLČŻĮæĘæÖŠ£¬Ņ”ŌČ”£Č”ÅضČĪŖ0.2000 mol”¤L1µÄH2C2O4±ź×¼ČÜŅŗ20.00 mL£¬¼ÓČėĻ”ĮņĖįĖį»Æ£¬ÓĆKMnO4ČÜŅŗĘ½ŠŠµĪ¶ØČż“Ī£¬Ę½¾łĻūŗĵÄĢå»żĪŖ24.48 mL£¬øĆѳʷµÄ“æ¶ČĪŖ £ØĮŠ³ö¼ĘĖćŹ½¼“æÉ£¬ŅŃÖŖ2MnO4-+5H2C2O4+6H+=2Mn2++10CO2”ü+8H2O£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŠæ¼°Ęä»ÆŗĻĪļÓĆĶ¾¹ć·ŗ”£»š·ØĮ¶ŠæŅŌÉĮŠææó£ØÖ÷ŅŖ³É·ÖŹĒZnS£©ĪŖÖ÷ŅŖŌĮĻÉę¼°µÄÖ÷ŅŖ·“Ó¦ÓŠ£ŗ 2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=£930 kJ”¤mol£1
H1=£930 kJ”¤mol£1
2C(s) + O2(g) = 2CO(g) ![]() H2=£221 kJ”¤mol£1
H2=£221 kJ”¤mol£1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3= +198 kJ”¤mol£1
H3= +198 kJ”¤mol£1
£Ø1£©·“Ó¦ZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g)µÄ![]() H4= kJ”¤mol£1”£
H4= kJ”¤mol£1”£
·“Ó¦ÖŠÉś³ÉµÄCO2ÓėNH3»ģŗĻ£¬ŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦ŗĻ³ÉÄņĖŲ£ŗ
![]()
ČōøĆ·“Ó¦ŌŚŅ»ŗćĪĀ”¢ŗćČŻĆܱÕČŻĘ÷ÄŚ½ųŠŠ£¬ÅŠ¶Ļ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒ ”£
a£®CO2ÓėH2O(g)ÅضČĻąµČ b£®ČŻĘ÷ÖŠĘųĢåµÄŃ¹Ēæ²»ŌŁøıä
c£®2v(NH3)Õż = v(H2O)Äę d£®ČŻĘ÷ÖŠ»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁøıä
£Ø2£©ĮņĖįŠææɹć·ŗÓĆ×÷Ó”Č¾Ć½Č¾¼ĮŗĶľ²Ä·ĄøƼĮ”£ ZnSO4ŹÜČČ·Ö½ā¹ż³ĢÖŠø÷ĪļÖŹĪļÖŹµÄĮæĖęĪĀ¶Č±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾”£
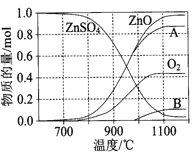
¢ŁŠ“³ö700”ę~980”ꏱ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ £¬ĪļÖŹBµÄ»ÆѧŹ½ŹĒ ”£
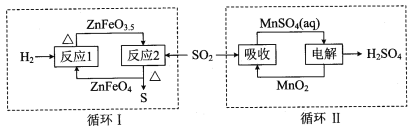
¢ŚĮņĖįŠæ·Ö½āÉś³ÉµÄSO2¾ĻĀĶ¼ÖŠµÄĮ½øöŃ»·æÉ·Ö±šµĆµ½SŗĶH2SO4”£Š“³öŃ»·IÖŠ·“Ó¦2µÄ»Æѧ·½³ĢŹ½£ŗ £»Ń»·IIÖŠµē½ā¹ż³ĢŃō¼«·“Ó¦Ź½ŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆ·“Ó³ĮĖŌŖĖŲµÄŌ×Ó½į¹¹ŗĶŌŖĖŲµÄŠŌÖŹ”£ĻĀŹĒŌŖĖŲÖÜĘŚ±ķµÄŅ»²æ·Ö”£
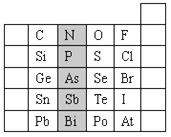
£Ø1£©ŅõÓ°²æ·ÖŌŖĖŲNŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆĪŖ ”£
øł¾ŻŌŖĖŲÖÜĘŚĀÉ£¬ĒėÄćŌ¤²ā£ŗH3AsO4”¢H3PO4 µÄĖįŠŌĒæČõ£ŗH3AsO4 H3PO4”££ØÓĆ”°£¾”±”¢”°£¼”±»ņ”°£½”±±ķŹ¾£©
£Ø2£©ŌŖĖŲSµÄ×īøßÕż¼ŪŗĶ×īµĶøŗ¼Ū·Ö±šĪŖ ”¢ £¬ŌŚŅ»¶ØĢõ¼žĻĀ£¬SÓėH2·“Ó¦ÓŠŅ»¶ØĻŽ¶Č(æÉĄķ½āĪŖ·“Ó¦½ųŠŠµÄ³Ģ¶Č)£¬ĒėÅŠ¶ĻŌŚĻąĶ¬Ģõ¼žĻĀSeÓėH2·“Ó¦µÄĻŽ¶Č(Ń”Ģī”°øü“ó”±”¢”°øüŠ””±»ņ”°ĻąĶ¬”±) ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com