
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析 ①若X为单质硫,M为氧气符合转化关系;
②若X为C,M为氧气等符合转化关系;
③若X为NaOH,M为CO2等符合转化关系;
④若X为NH3,M为氧气符合转化关系.
解答 解:①若X为单质硫,M为氧气,二者反应生成Y为SO2,SO2与氧气继续反应得到SO3,符合转化关系,故①符合;
②若X为C.M为氧气,二者反应得到Y为一氧化碳,一氧化碳与氧气反应得到二氧化碳,符合转化关系,故②符合;
③若X为NaOH,M为CO2,二者反应得到碳酸钠,碳酸钠与二氧化碳反应得到碳酸氢钠,符合转化关系,故③符合;
④若X为NH3,M为氧气,二者反应得到NO,NO与氧气反应得到二氧化氮,符合转化关系,故④符合,
故选:D.
点评 本题考查无机物推断,涉及硫、氮、铝、钠等元素化合物性质与转化,熟练掌握元素化合物性质是关键,注意归纳总结中学常见X$\stackrel{M}{→}$Y$\stackrel{M}{→}$Z型转化关系,难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题
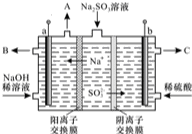 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
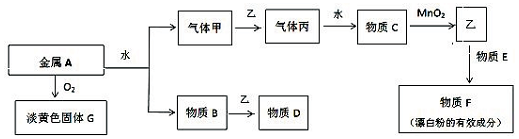
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 | |
| B. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0升高温度使平衡向逆方向移动 | |
| C. | 合成氨反应:N2(g)+3H2(g)?2NH3(g)△H<0,为使氨的产率提高,理论上应采取低温高压的措施 | |
| D. | 在溴水中存在如下平衡:Br2(g)+H2O(l)?HBr(aq)+HBrO(aq),当加入NaOH溶液后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
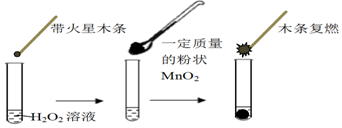
| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气 泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
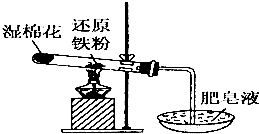 常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应.小明设计如下实验探究铁粉与水蒸气反应后的气体产物.
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应.小明设计如下实验探究铁粉与水蒸气反应后的气体产物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
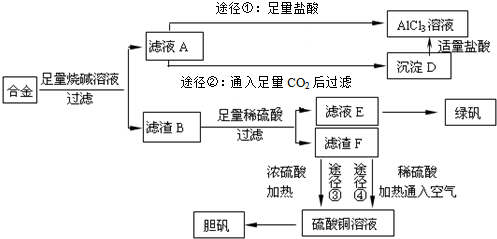
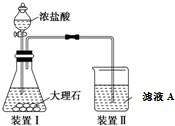
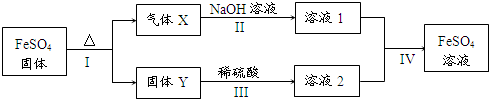
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com