
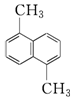
 物质A的分子式为C12H12,结构简式为如图,已知苯环上的二溴代物有9种同分异构体,由此推测A的苯环上的四溴代物的异构体数目有( )
物质A的分子式为C12H12,结构简式为如图,已知苯环上的二溴代物有9种同分异构体,由此推测A的苯环上的四溴代物的异构体数目有( )| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
分析 用换元法解答,苯环上的四溴代物可以看作苯环六溴代物其中2个溴原子被2个H原子取代,故二溴代物与四溴代物同分异构体数目相同,以此解答该题.
解答 解:苯环上的四溴代物可以看作苯环六溴代物其中2个溴原子被2个H原子取代,故四溴代物与二溴代物同分异构体数目相同,由于二溴代物有9种同分异构体,故四溴代物的同分异构体数目也为9种,故选A.
点评 本题考查同分异构数目的判断,为高频考点,侧重于学生的分析能力的考查,难度中等,注意换元法的利用,芳香烃的苯环上有多少种可被取代的氢原子,就有多少种取代产物,若有n个可被取代的氢原子,那么m个取代基(m<n)的取代产物与(n-m)个取代基的取代产物的种数相同.


科目:高中化学 来源: 题型:解答题
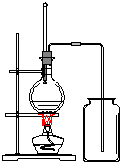 实验室是用乙醇在浓硫酸和170℃条件下制取乙烯的.
实验室是用乙醇在浓硫酸和170℃条件下制取乙烯的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
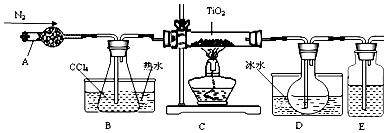
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
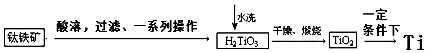
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麻古(冰毒片剂) | B. | K粉(氯胺酮) | C. | 大麻(四氢大麻酚) | D. | 抗酸药 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 日常生活中无水乙醇常用于杀菌消毒 | |
| C. | SO2具有漂白性,能使碘的淀粉溶液由蓝色变为无色 | |
| D. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象 |
| 步骤一:用胶头滴管取出A试管中的溶液,用水稀释后,并分装在试管Ⅰ、Ⅱ中备用 | |
| 步骤二:检验Fe3+,往试管Ⅰ中,滴入几滴KSCN溶液 | 溶液呈现血红色 |
| 步骤三:检验Fe2+,往试管Ⅱ中,滴入少量KMnO4溶液(或先滴入几滴稀硫酸) | 紫红色变浅或消褪 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com