
【题目】某旧电器的金属部件中Zn、Fe、Cu、Ag等金属单质,与足量稀盐酸反应后过滤,剩余固体中不可能含有
A. FeB. Zn
C. CuD. Ag
科目:高中化学 来源: 题型:
【题目】(题文)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(1)反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2_______p 1(填“>”或“<”),得出该结论的理由是________________。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+![]() S↓+2I2+2H2O
S↓+2I2+2H2O
ii.I2+2H2O+_________![]() _________+_______+2 I-
_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用如图所示装置进行实验,探究铁和浓硫酸反应的产物及性质。(夹持装置已略,气密性已检验)
实验开始前,先打开活塞K通一段时间N2。关闭活塞K后,向A中滴加一定量的浓硫酸,加热观察到A中铁片上有气泡产生。
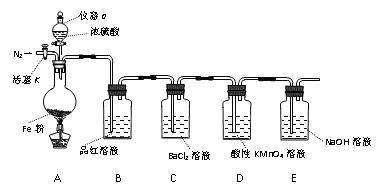
请回答下列问题:
(1)仪器a的名称是____。实验开始前,先通一段时间N2的目的是____。
(2)加热一段时间后发现B装置中溶液褪色,说明有____(填化学式)生成。再取出A中反应后的溶液少许,加入KSCN溶液未出现血红色,浓硫酸与铁反应的化学方程式是____。
(3)C装置中____(填“有”或“无”)沉淀生成。D中溶液紫色褪去,体现气体产物的____性(填“氧化”、“还原”或“漂白性”)。
(4)E装置的作用是____。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。

已知:lgX=lg![]() 或lg
或lg![]() ,下列叙述正确的是
,下列叙述正确的是
A. 曲线m表示pH与lg![]() 的变化关系
的变化关系
B. 当溶液呈中性时,c(Na+)=![]() +2
+2![]()
C. Ka1(H2CO3)=1.0×10-6.4
D. 25℃时,CO32-+H2O![]()
![]() +OH-的平衡常数为1.0×10-7.6
+OH-的平衡常数为1.0×10-7.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图①是镁-次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图②是Cr2O72-的工业废水的处理。下列说法正确的是( )

A. 图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图②的电解池中,有0.084g阳极材料参与反应,阴极会有336mL的气体产生(标况)
C. 图①中发生的还原反应是:Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
D. 若图①中3.6g镁溶解产生的电量用以图②废水处理,理论可产生10.7g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
Ⅰ.(1)铁元素在周期表中的位置为___________。
(2)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是___________ (填字母)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
Ⅱ.下图是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、SiO2)为原料制备高纯氧化铁的生产流程示意图:

回答下列问题:
(1)酸浸、过滤后滤液A中的金属阳离子是 ___________ 。
(2)煅烧FeCO3生成产品Ⅰ的化学方程式为___________。
(3)已知几种盐的溶解度随温度变化的曲线如图所示,产品Ⅱ的化学式为 ___________ 。

(4)写出步骤Ⅳ反应的离子方程式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com