
| A、pH=3的溶液:Ca2+、CH3COOH、Br-、Na+ |
| B、水电离的c(H+)=1×10-13mo1?L-1的溶液:Na+、K+、SO42-、CO32- |
| C、含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- |
| D、含有大量NO3-的溶液:NH4+、H+、SO42-、I- |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
| A、NaHCO3溶液中的水解:HCO3-+H2O?H3O++CO32- |
| B、氯化铁溶液中通入硫化氢:2Fe3++H2S=2Fe2++S↓+2H+ |
| C、CaCl2溶液中通入CO2:Ca2++CO2+H2D=CaCO3↓+2H+ |
| D、NaHSO4溶液中逐滴加入Ba(OH)2溶液至恰好呈中性:Ba2++OH-+H-+SO42-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCl2 和(NH4)2C03 |
| B、AgNO3 和 NH4Cl |
| C、FeCl3和 NaHCO3 |
| D、KCl 和 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4克金属镁变成镁离子时失去的电子数目为0.1NA(NA代表阿伏加德罗常数) |
| B、40g NaOH溶解于500mL水中,所得溶液的物质的量浓度为2mol?L-1 |
| C、1mol H2的质量是2g?mol-1 |
| D、等物质的量的O3和H2O中所含的原子个数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知下列反应(反应所需的条件、反应物的浓度和方程式中各物质的化学计量数均已略去):
已知下列反应(反应所需的条件、反应物的浓度和方程式中各物质的化学计量数均已略去):查看答案和解析>>
科目:高中化学 来源: 题型:
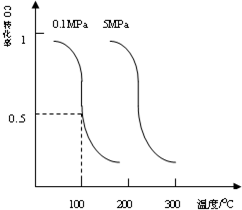 研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com