
 有A、B、C、D、E、F六种常见物质,将它们分别溶于水,所得溶液颜色各不相同.已知:
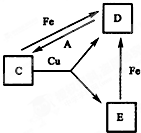
有A、B、C、D、E、F六种常见物质,将它们分别溶于水,所得溶液颜色各不相同.已知:分析 ①A常温下为黄绿色气体,应为Cl2;②B为淡黄色固体,溶于水同时有无色气体放出,应为Na2O2,与水反应生成氧气;③C、D所含元素相同,溶液中C、D、E能发生右图所示转化,可知C为FeCl3,D为FeCl2,E为CuCl2;④F是一种钾盐,受热时也会产生②中的无色气体,分解剩余固体与浓盐酸共热可生成气体A,可知F为KMnO4,结合对应物质的性质以及题目要求解答该题.
解答 解:A常温下为黄绿色气体,应为Cl2,B为淡黄色固体,溶于水同时有无色气体放出,应为Na2O2,与水反应生成氧气,C、D所含元素相同,溶液中C、D、E能发生右图所示转化,可知C为FeCl3,D为FeCl2,E为CuCl2,F是一种钾盐,受热时也会产生②中的无色气体,分解剩余固体与浓盐酸共热可生成气体A,可知F为KClO3,
(1)由以上分析可知A为Cl2,F为KMnO4,
故答案为:Cl2;KMnO4;
(2)反应②为花氧化钠与水的反应,方程式为:2Na2O2+2H2O=4NaOH+O2↑,反应中既是氧化剂又是还原剂,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;Na2O2;
(3)C为FeCl3,D为FeCl2,D转变为C的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;C转化为D和E的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;2Fe3++Cu=2Fe2++Cu2+;
(4)②的反应为:2Na2O2+2H2O=4NaOH+O2↑,④的反应为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
由于过氧化钠中氧元素的化合价为-1价,过氧化钠与水反应生成1mol氧气转移了2mol电子,
而高锰酸钾中氧元素的化合价为-2价,生成1mol氧气需要转移4mol电子,所以生成等量的氧气,转移电子数之比为:1:2,
故答案为:1:2.
点评 本题考查无机物的推断,题目难度中等,侧重于学生的分析能力和计算能力的考查,为高考常见题型,注意把握推断的突破口,明确物质的种类为解答该题的关键.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广垃圾分类存放,分类回收,分类处理 | |
| B. | 改革传统采煤时将煤层气(瓦斯气,主要成分甲烷)直接排入空气的做法,采用先开采和综合利用煤层气,然后再采煤的方法 | |
| C. | 推荐使用手帕,尽量减少使用面纸 | |
| D. | 将工厂的烟囱造高,以减少工厂周围的大气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
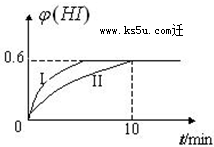 将1mol I2(g) 和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,2min时,测得I2的物质的量为0.6mol.10min后达到平衡,HI的体积分数φ(H)随时间变化如下图中曲线II所示.
将1mol I2(g) 和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,2min时,测得I2的物质的量为0.6mol.10min后达到平衡,HI的体积分数φ(H)随时间变化如下图中曲线II所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁作阳极,电解饱和食盐水的离子方程式:Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2↓+H2↑ | |
| B. | 溴乙烷的消去反应:CH3CH2Br$→_{△}^{浓硫酸}$ CH2=CH2↑+HBr | |
| C. | CH4燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(g) H=-802.3 kJ•mol-1 | |
| D. | 示踪原子法研究乙酸与乙醇酯化反应: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 在AlCl3溶液中加入过量氨水最终无沉淀生成 | |
| C. | 工业上可利用钠和TiCl4溶液反应制取金属Ti | |
| D. | 锅炉中水垢可用盐酸或醋酸除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0g C2H6的中含有公用电子对的数目为0.7×6.02×1023 | |
| B. | 25℃时,pH=1的醋酸中H+含有的数目为0.1×6.02×1023 | |
| C. | 已知2CO(g)+O2(g)?2CO2(g)△H=+-a kJ•mol-1,将2 NA 个CO与 NA 个O2混合,充分反应放出a kJ的热量 | |
| D. | 50mL 18.4mol•L-1 浓硫酸与足量铜微热反应生成 SO2分子数目为0.46NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com