
 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源:2016届西藏日喀则一中高三下学期二模考试理综化学试卷(解析版) 题型:填空题
有机化合物K在化工和医药方面有重要的应用,其合成路线如下:

已知信息:
①C能发生银镜反应,E的相对分子质量比D大4,G的苯环上的一溴代物有两种
②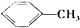
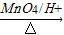

③2RCH2CHO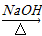
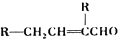
请回答下列问题:
(1)F的名称是__________,H含有的官能团是__________。
(2)A→B的反应类型是__________,F→G的反应类型是__________。
(3)C与银氨溶液反应的化学方程式是__________。
(4)K的结构简式是__________。
(5)符合下列要求的C8H10O的同分异构体有__________种.
①芳香族化合物②与Na反应并产生H2③遇FeCl3溶液呈紫色,
其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是__________(写出其中一种结构简式)
(6)参照已知信息和成路线,设计一条由CH2=CH2为原料合成CH3CH2CH2CH2OH的路线(注明反应条件):__________。
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古赤峰二中高三第四次模拟理综化学试卷(解析版) 题型:填空题
锰是一种银白色的脆性金属,强度不如铁,但把锰加到钢铁中,竟然能使钢铁的强度提高4~8倍,而且还提高了钢的耐磨性,所以锰钢在工农业生产及国防建设中有着广泛的用途。
用阴离子膜电解法的新技术从含有MnCO3、MnO2、FeCO3、SiO2、Al2O3等成分的锰矿石中提取金属锰,其工艺流程如下:
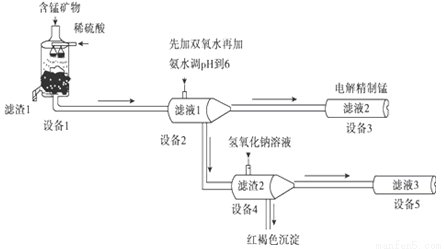
已知FeCO3、MnCO3难溶于水.
(1)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2.则滤渣1的主要成分是_________(填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是_________。
(3)设备2中加足量双氧水的作用是_________。设计实验方案检验滤液2中是否存在Fe2+:_________。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解.用化学平衡移动原理解释原因:_________。
(5)设备3中用阴离子膜法提取金属锰的电解装置如图:
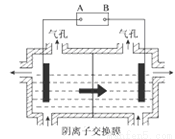
①电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的_________极。实际生产中,阳极以稀硫酸为电解液,其电极反应式为_________。
②该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下期中化学试卷(解析版) 题型:选择题
原子序数依次增大的元素W、X、Y、Z,它们的最外层电子数分别为1、6、7、1。W-的电子层结构与氦相同,X和Y的次外层有8个电子,Y-和Z+的电子层结构相同。下列叙述错误的是( )
A.元素的非金属性次序为Y>X>W
B.W和其他3种元素均能形成共价化合物
C.Z和其他3种元素均能形成离子化合物
D.元素W、X、Y各自最高和最低化合价的代数和分别为0、4、6
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下期中化学试卷(解析版) 题型:选择题
对于锌、铜和稀硫酸构成的原电池,下列有关说法正确的是( )
①Zn是负极 ②Cu是正极
③负极反应:Zn—2e-=Zn2+ ④正极反应:Cu2++2e-=Cu
⑤H+向负极移动 ⑥电子由Cu极通过导线向Zn极移动
A.仅①②③⑤ B.①②③④⑤
C.仅②③④⑥ D.仅①②③
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:填空题
Ⅰ、单质硅由于其成熟的生产工艺, 丰富的生产原料及优异的性能被广泛用于电子行业及太阳能电池的生产等,在二氧化碳氛围中通过利用金属钠来还原二氧化硅可在较低的温度条件下得到硅,同时生成一种盐X,这相比起现有的生产工艺具有节约能耗的优势。
(1)写出上述制备硅的化学反应方程式 。
(2)二氧化硅与二氧化碳物理性质差别很大,原因是 。
(3)盐X的溶液能与Al2(SO4)3溶液反应生成一种白色沉淀和气体。写出此反应的离子反应方程式 。
Ⅱ、某盐A有3种元素组成,易溶于水。将A加热,生成既不助燃,也不使湿润的红色或蓝色石蕊试纸变色的气体B和H2O。将A溶于水,进行下列实验:①酸性条件下与H2S作用生成淡黄色沉淀C,同时放出无色气体D,D在空气中转变为红棕色气体E;②当通入足量Cl2时,无明显现象,但将所得溶液浓缩后即可得到无色晶体盐F。请回答下列问题:
(1)写出A的化学式: ; B的电子式: 。
(2)写出上述实验①、②所发生的离子反应方程式:
① ;② 。
(3)D、E对环境有危害,可用NaOH溶液来吸收等物质的量的D、E混合气体,写出其化学反应方程式 。
(4)判断盐F的可能成份 ;设计实验方案确定F的成份 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:选择题
在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3;②Fe2O3;③Cu(NO3)2;④KNO3,铜粉溶解的是( )
A.只有①或②
B.只有②或④
C.只有①或②或③
D.上述四种物质中任意一种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:计算题
将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟九化学试卷(解析版) 题型:实验题
H为芳香酯,其合成路线如下图,A ~ G 均为芳香族化合物,B能发生银镜反应,D的相对分子质量比C大4,E的核磁共振氢谱有3组峰
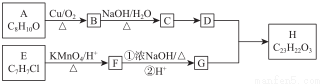
①2RCH2CHO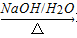 R-
R-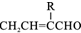
②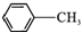
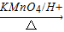
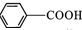
请回答下列问题:
(1)A的名称是________,B含有的官能团的名称是________;
(2)A→B的反应类型为________,C→D的反应类型是________;
(3)B、E的结构简式分别为___________、___________;
(4)E→F与F→G的顺序能否颠倒_____(填“能”或“否”),理由_______;
(5)符合下列要求的A的同分异构体有多种,其中核磁共振氢谱为4组峰,且面积比为6:2:1:1_________;(写出其中一种的结构简式)。
①与Na反应并产生H2 ②芳香族化合物
(6)根据已有知识,结合相关信息,写出CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成流程图(无机试剂任选),合成流程示意图如下:
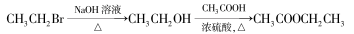
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com