
水溶液中能大量共存的一组离子是( )
A.Na+、Ca2+、Cl-、SO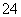
B.Fe2+、H+、SO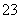 、ClO-
、ClO-
C.Mg2+、NH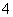 、Cl-、SO
、Cl-、SO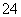
D.K+、Fe3+、NO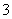 、SCN-
、SCN-
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
请回答下列问题:
(1)图中A、C分别表示__________、__________,E的大小对该反应的反应热有无影响?__________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________,理由是_________________________________________________________;
(2)图中ΔH=__________kJ·mol-1;
(3)V2O5的催化循环机理可能为V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:________________________________________________________________________;
(4)已知常温下,1 mol固体硫燃烧生成二氧化硫气体时放出的热量是296 kJ,计算由S(s)生成3 mol SO3(g)的ΔH________(要求写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
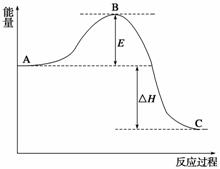
海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示:
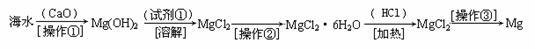
回答下列问题:
(1)写出在海水中加入氧化钙生成氢氧化镁的化学方程式
;
(2)操作①主要是指 ;试剂①可选用 ;
(3)操作②是指 ;经操作③最终可得金属镁。
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C10H14,属于苯的同系物,且苯环上的一氯代物只有2种的有机物有(不考虑立体异构,苯环上至少有3个氢)
A.5种 B.6种 C.7种 D.8种
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组的同学对电化学原理进行了一系列探究活动
⑴如图为某实验小组依据氧化还原反应:(用离子方程式表示) 设计的原电池装置,反应前,两电极质量相等,一段时间后,两电极质量相差18g,则导线中通过 mol电子。
⑵用胶头滴管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式 ,然后滴加几滴硫氰化钾溶液,溶液变红;继续滴加过量新制饱和氯水,红色褪去,假设之一是“溶液中的+3价铁被氧化为更高的价态”。如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
⑶如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,石墨⑴为 极(填 “正”、“负”、“阴”或 “阳”)。在甲装置中滴加几滴酚酞试液,振荡均匀,一段时间后,在甲装置中观察到 电极(填“铁”或“铜”)附近溶液先变红,该电极的反应式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液中能大量共存的一组离子是( )
A.Fe3+、Cl-、I-、Na+
B.NH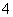 、Al3+、NO
、Al3+、NO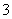 、Cl-
、Cl-
C.Ca2+、K+、Cl-、CO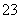
D.K+、H+、F-、SO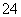
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列离子方程式
(1)[2013·北京理综,27(1)]H2SO4溶解Al2O3的离子方程式是________________________。
(2)[2013·海南,13(3)]H和O元素组成的化合物中,既含有极性共价键又含有非极性共价键的是__________。此化合物在酸性条件下与高锰酸钾反应的离子方程式为________________;此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为__________________。
(3)[2013·海南,14(1)]海水提溴过程中,向浓缩的海水中通入________,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO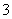 ,其离子方程式为____________________________。
,其离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某pH=1的工业废液,只可能含有以下离子中的若干种:H+、Mg2+、Ba2+、Cl-、CO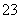 、SO
、SO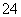 ,现取两份100 mL溶液进行如下实验:
,现取两份100 mL溶液进行如下实验:
实验1:向第一份溶液中加入足量AgNO3溶液,干燥得沉淀3.50 g。
实验2:向第二份溶液中加入足量BaCl2溶液后,干燥得沉淀2.33 g,经足量盐酸洗涤、干燥后,沉淀质量不变。
根据上述实验,以下推测正确的是( )
①一定存在Mg2+ ②可能存在CO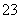 ③一定存在Cl- ④可能存在Ba2+ ⑤可能存在Mg2+
③一定存在Cl- ④可能存在Ba2+ ⑤可能存在Mg2+
A.①③ B.②③
C.③⑤ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.酸式盐的溶液一定显酸性
B.只要酸与碱的物质的量浓度和体积分别相同,它们反应后的溶液就呈中性
C.纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等
D.碳酸溶液中氢离子物质的量浓度是碳酸根离子物质的量浓度的二倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com