
 Al(OH)3+OH-(1分)
Al(OH)3+OH-(1分) 和S
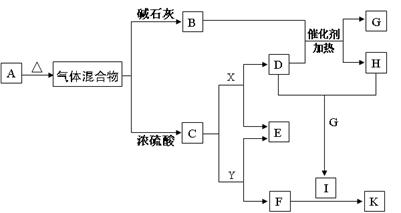
和S ,但a、b、c、d、e、f为原子序数依次增大的短周期元素,则b原子序数较小只能为C。d、e元素可形成两种离子化合物,且阳离子与阴离子的个数比都为2 : 1,则d只能是O元素,e只能是Na元素,X可能为Na2O2或Na2O。a、b、c、d四种元素形成酸式盐A,则A为NH4HCO3。NH4HCO3=NH3+H2O+CO2,则C为CO2,B为NH3。X为Na2O2,D为O2,G为H2O,H为NO,I为NO2。F为白色胶状物质,则F为Al(OH)3,则Y为NaAlO2,K为Al(NO3)3。
,但a、b、c、d、e、f为原子序数依次增大的短周期元素,则b原子序数较小只能为C。d、e元素可形成两种离子化合物,且阳离子与阴离子的个数比都为2 : 1,则d只能是O元素,e只能是Na元素,X可能为Na2O2或Na2O。a、b、c、d四种元素形成酸式盐A,则A为NH4HCO3。NH4HCO3=NH3+H2O+CO2,则C为CO2,B为NH3。X为Na2O2,D为O2,G为H2O,H为NO,I为NO2。F为白色胶状物质,则F为Al(OH)3,则Y为NaAlO2,K为Al(NO3)3。

科目:高中化学 来源:不详 题型:填空题
| A.浓硫酸 | B.碱石灰 | C.五氧化二磷 | D.固体NaOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
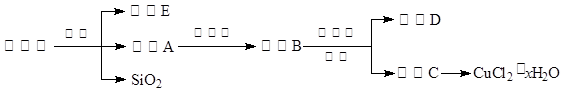
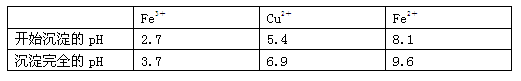
| A.氨水 | B.氧化铜 | C.氢氧化铜 | D.氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.容量瓶使用前有蒸馏水 |
| B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 |
| C.俯视确定凹液面与刻度线相切 |
| D.称量NaOH固体时使用了称量纸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

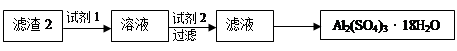
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5~9 | B.4.0~10.0 | C.4.3~9.7 | D.以上都不正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 |  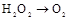 | |
| ② | 制氨气 | 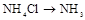 | |
| ③ | 制氯气 | 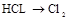 | |
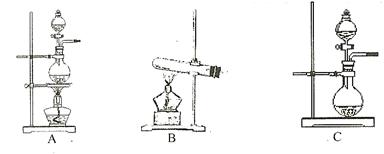
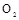 的装置制备
的装置制备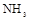 ,应选择的试剂为 .
,应选择的试剂为 .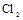 需用
需用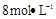 的盐酸1OOml,现用
的盐酸1OOml,现用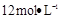 的盐酸来配制。
的盐酸来配制。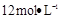 的盐酸的体积为 mL;
的盐酸的体积为 mL;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com