
| A、在标准状况下,NA个水分子所占的体积约为22.4L |
| B、5.6g铁与氯气完全反应,失去电子的数目为0.2NA |
| C、足量Na与1molC12完全反应,转移的电子数为2NA |
| D、22.4L由N2、N2O组成的混合气体中所含有的氮原子的物质的量为2mol |
| 5.6 |
| 56 |


科目:高中化学 来源: 题型:
| ||
| A、催化脱氢反应中NH3BH3作氧化剂 |
| B、NH4BO2和NH3BH3含有的化学键不完全相同 |
| C、0.1 mol NH3BH3发生催化脱氢反应,可以生成6.72 L H2 |
| D、元素N的第一电离能小于元素O |
查看答案和解析>>
科目:高中化学 来源: 题型:
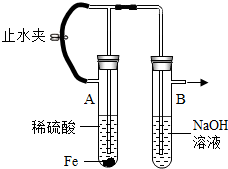 下图为Fe(OH)2制备实验的改进装置,使用该装置将能在较长时间内观察到白色絮状沉淀.关于此实验,下列说法正确的是( )
下图为Fe(OH)2制备实验的改进装置,使用该装置将能在较长时间内观察到白色絮状沉淀.关于此实验,下列说法正确的是( )| A、装入药品后应关闭铁夹,等反应完成后再打开铁夹 |
| B、此装置是通过H2的排出使A中压强减小,从而将B中的烧碱吸入A中产生Fe(OH)2 |
| C、H2的作用是排尽装置内的空气和将A中溶液压人B中 |
| D、在药品用量上硫酸应过量,使铁粉能充分反应完 |
查看答案和解析>>
科目:高中化学 来源: 题型:
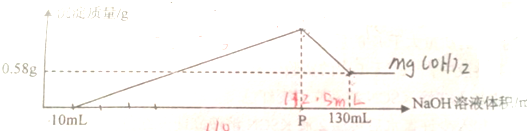
| A、盐酸的物质的量浓度为0.22mol/L |
| B、混合物中Al2O3的物质的量为0.01mol |
| C、混合物中MgO的物质的量为0.01mol |
| D、P点加入NaOH溶液的体积是110mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、3 | C、4 | D、5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
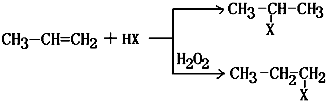 (X)为卤素原子
(X)为卤素原子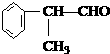 的物质,该物质是一种香料.
的物质,该物质是一种香料.
查看答案和解析>>
科目:高中化学 来源: 题型:
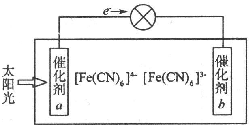 铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.
铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
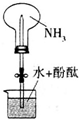 化学是一门以实验为基础的科学.
化学是一门以实验为基础的科学.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com