
已知A为生活中的常见金属,C为磁性黑色晶体,A、B、C、D之间转化关系

(1)写出以下物质的化学式A_________、C__________、D___________。
(2)C+盐酸→B+D的离子方程式为____________________________,D的溶液可作为
印刷电路板“腐蚀液”,写出该反应的化学方程式______________________。
(3)实验室保存B的溶液时常加入少量A,原因是_________________________(用
离子方程式表示)
(4)向B溶液中滴加NaOH溶液,产生的现象是___________________,过程中所发
生的氧化还原反应的化学方程式是________________。
科目:高中化学 来源:2016-2017学年江苏省高二3月学业水平测试化学试卷(解析版) 题型:选择题
下列物质中,只含有共价键的是( )
A. Ar B. KOH C. CH3COONa D. N2
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期第四次月考理科综合化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为16。Y的原子半径比X 的大,X与W同主族,Z是地壳中含量最高的金属元素。下列说法正确的是
A. 原子半径的大小顺序: r(W)>r(Z)>r(Y)
B. 元素X、Y只能形成一种化合物
C. 元素W的简单气态氢化物的热稳定性比X的强
D. Y、W最高价氧化物所对应的水化物均能溶解Z的氢氧化物
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市长望浏宁四县高三3月模拟考试理综化学试卷(解析版) 题型:简答题
以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用。其工作流程如下图所示:
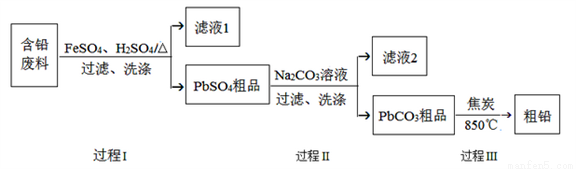
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42- 2Fe3++PbSO4+2H2O
2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.___________。
(3)过程Ⅱ的目的是脱硫。若滤液2中c(SO42-)=1.6mol/L,c(CO32-)=0.1mol/L,则PbCO3中____(填“是”或“否”)混有PbSO4。
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图所示。将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发 生反应:PbSO4 + 3OH- = HPbO2-+ SO42- +H2O。
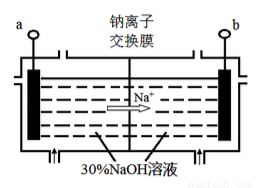
①a与外接电源的________极相连。
②电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为___________。
③与传统无膜固相电解法相比,使用钠离子交换膜可以 提高Pb元素的利用率,原因是________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市长望浏宁四县高三3月模拟考试理综化学试卷(解析版) 题型:选择题
常温下0.1mol/L醋酸溶液的PH=a,下列能使溶液PH=(a+1)的措施是
A. 将溶液稀释到原体积的10倍
B. 加入适量的醋酸钠固体
C. 加入等体积0.2 mol•L-1盐酸
D. 提高溶液的温度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一下学期第一次月考化学试卷(解析版) 题型:选择题
在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为 ( )
A. 0.1mol B. 0.5mol C. 0.15mol D. 0.25mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一下学期第一次月考化学试卷(解析版) 题型:选择题
根据表中信息判断,下列选项不正确的是( )
序号 | 反应物 | 产物 |
① | KMnO4 、H2O2 、H2SO4 | K2SO4 、MnSO4 ...... |
② | Cl2 、FeBr2 | FeCl3 、FeBr3 |
③ | MnO4- Cl- ...... | Cl2 、Mn2+ ...... |
A. 氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ > Br2
B. 第②组反应从产物结果可以得出还原性顺序:Fe2+ > Br-
C. 第③组反应中生成1mol Cl2,转移电子数为2NA
D. 第①组反应的其余产物为H2O和 O2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:选择题
已知温度T时水的离子积常数为KW.该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是:
A. a = b
B. 混合溶液的pH = 7
C. 混合溶液中,c(H+) =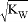 mol/L
mol/L
D. 混合溶液中,c(H+) + c(B+) = c(OH-) + c(A-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高一上学期期末考试化学试卷(解析版) 题型:实验题
实验室现需配制物质的量浓度为1 mol·L-1的NaOH溶液480 mL。
(1)配制该溶液的实验步骤包括:
a.计算需要氢氧化钠固体的质量;
b.称量氢氧化钠固体;
c.将烧杯中的溶液注入________________;
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却;
e.盖好瓶塞,反复上下颠倒,摇匀;
f.继续向容量瓶中加蒸馏水至刻度线下1~2 cm时,改用___________滴加蒸馏水至凹液面与刻度线相切。
①实验过程中用到的玻璃仪器有:烧杯、量筒、玻璃棒、_____________、________。
②上述步骤的正确操作顺序是__________________________________。
(2)要配制此溶液,需要称量NaOH固体的质量为____________克。
(3)下列操作会使所配制溶液浓度偏大的有__________________。
A.溶解固体溶质时,未冷却至室温即转入容量瓶进行定容
B.定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时观察液面仰视
(4)配制好的NaOH溶液不能用带磨口玻璃塞的试剂瓶存放,请用化学方程式解释原因________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com