
| A. | 电池工作时,锌失去电子,锌是负极 | |
| B. | 电池工作时,溶液中OH-向正极移动,K+、H+向负极移动 | |
| C. | 电池负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
分析 该原电池中,Zn失电子作负极、二氧化锰作正极,负极反应式为Zn-2e-+2OH-═Zn(OH)2,正极反应式为2MnO2+H2O+2e-=Mn2O3+2OH-,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,据此分析解答.
解答 解:A、原电池工作原理是,负极失电子,发生氧化反应,故A正确;
B、电池工作时,电子由负极流向正极,根据异性电荷相吸,溶液中K+、H+向正极移动,OH-向负极移动,故B错误;
C、负极失电子,发生氧化反应,所以负极的电极反应式为:Zn-2e-+2OH-=Zn(OH)2,故C正确;
D、由Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)可知,65gZn反应转移电子为2mol,则6.5gZn反应转移0.2mol电子,故D正确;
故选B.
点评 本题考查了原电池、电解池工作原理,理解这类题的关键是理解原电池原理,在反应中,电子从负极经外电路流向正极,同时溶液中的阴、阳离子分别不断移向负极、正极,构成闭合回路.


科目:高中化学 来源: 题型:选择题
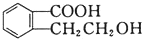 可以通过不同的反应得到①
可以通过不同的反应得到①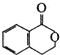 、②
、②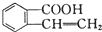 、③
、③ 三种物质.生成这三种有机物的反应类型依次为( )
三种物质.生成这三种有机物的反应类型依次为( )| A. | 酯化、取代、缩聚 | B. | 酯化、消去、缩聚 | C. | 取代、消去、加聚 | D. | 取代、消去、酯化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化工厂周围种绿色植物 | |
| B. | 不得排放废水、废气、废渣 | |
| C. | 以绿色植物为原料,用生物催化剂进行化工生产,且原子利用率达到100% | |
| D. | 尽可能减少对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
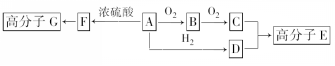
 .
. +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com