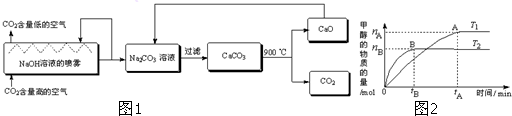
二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用NaOH溶液喷淋“捕捉”空气中的CO
2(如图1).
(1)NaOH溶液喷成雾状的目的是
.
(2)若使用1.0mol/L 800mL的NaOH溶液吸收11.2L(标准状况)的CO
2,反应的离子方程式为
,所得溶液中,n(CO
32-)、n(H
2CO
3)、n(H
+)、n(OH
-)的关系为
=0.3mol.
(3)以CO
2与NH
3为原料可合成化肥尿素[CO(NH
2)
2].已知:
①2NH
3(g)+CO
2(g)=NH
2CO
2NH
4(s)△H=-159.47kJ?mol
-1②NH
2CO
2NH
4(s)=CO(NH
2)
2(s)+H
2O(g)△H=+116.49kJ?mol
-1③H
2O(l)=H
2O(g)△H=+88.0kJ?mol
-1试写出NH
3和CO
2合成尿素和液态水的热化学方程式
.
(4)以CO
2与H
2为原料还可合成液体燃料甲醇(CH
3OH),其反应的化学方程为:
CO
2(g)+3H
2(g) CH
3OH(g)+H
2O(g)△H<0.现将1mol CO
2和3mol H
2充入
容积为2L的密闭容器中发生上述反应,下列说法正确的是
.
A.若保持恒温,当容器中n(CH
3OH):n(H
2O)为1:1时,该反应已达平衡状态
B.若保持恒温,当容器内气体压强恒定时,该反应已达平衡状态
C.若其他条件不变,实验结果如图2所示( T
1、T
2均大于300℃),则平衡常数:K(T
1)<K (T
2)
D.保持温度不变,当反应已达平衡时,若向容器中再充入1mol CO
2和3mol H
2,当达到新平衡时,n(CH
3OH):n(H
2)将升高;
(5)一小块未被氧化的金属钠在CO
2中加热,使其充分反应.
①反应所得固体产物中n (Na):n (O)=6:7.
②反应所得固体溶于水无气体产生,静置,取上层清液加过量BaCl
2溶液产生白色沉淀,再滴加酚酞,溶液呈红色.写出CO
2与金属钠反应的化学方程式
.