
【题目】软性隐形眼镜是由甲基丙烯酸羟乙酯[CH2=C(CH3)COOCH2CH2OH]的高聚物HEMA制成的超薄镜片,其合成路线可以是:

已知:① ![]()
② CH3COOCH2CH2OH的名称为乙酸羟乙酯。试写出:
(1)A、E的结构简式分别为:A 、E 。
(2)写出下列反应的反应类型:C→D ,E→F 。
(3)写出下列转化的化学方程式:
I→G ;
G+F→H 。
【答案】(1)CH2=CHCH3 (2分) (CH3)2C(OH)COOH (2分)(2)氧化;消去 (各2分)
(3)CH2ClCH2Cl+2H2O![]() HOCH2CH2OH+2HCl (2分)
HOCH2CH2OH+2HCl (2分)
HOCH2CH2OH+CH2=C(CH3)COOH![]() CH2=C(CH3)COOCH2CH2OH+H2O (2分)
CH2=C(CH3)COOCH2CH2OH+H2O (2分)
【解析】
试题分析:A和HBr反应生成B,B是溴丙烷,所以根据B的化学式可知A是丙烯,其结构简式是CH2=CHCH3。由于HEMA的单体是甲基丙烯酸羟乙酯,所以由转化图可知H应为甲基丙烯酸羟乙酯,即CH2=C(CH3)COOCH2CH2OH。乙烯与氯气发生加成反应生成1,2-二氯乙烷,则I是1,2-二氯乙烷,结构简式为ClCH2CH2Cl。I水解生成G,则G是乙二醇,其结构简式为HOCH2CH2OH。G和F在浓硫酸的作用下生成H,所以根据H和G的结构简式可知,F的结构简式应为CH2=C(CH3)COOH。E在浓硫酸的作用下加热生成F,这说明该反应应该是消去反应,所以E的结构简式为(CH3)2C(OH)COOH。根据已知信息①并结合E的结构简式可知,D的结构简式应该是CH3COCH3,即D是丙酮。C是醇,可以转化为丙酮,这说明C是2-丙醇,结构简式为CH3CHOHCH3,C发生催化氧化生成D。B水解生成C,所以B的是2-溴丙烷,结构简式为CH3CHBrCH3。
(1)由以上分析可知A和E的结构简式分别为CH2=CHCH3、(CH3)2C(OH)COOH。
(2)C为CH3CHOHCH3,D为丙酮,C生成D的反应为氧化反应,E为(CH3)2C(OH)COOH,F为CH2=C(CH3)COOH,E生成F的反应为消去反应。
(3)I为CH2ClCH2Cl,发生取代反应可生成HOCH2CH2OH,反应的方程式为CH2ClCH2Cl+2NaOH![]() HOCH2CH2OH+2NaCl;G为HOCH2CH2OH,F为CH2=C(CH3)COOH,二者发生酯化反应,反应的方程式为
HOCH2CH2OH+2NaCl;G为HOCH2CH2OH,F为CH2=C(CH3)COOH,二者发生酯化反应,反应的方程式为
HOCH2CH2OH+CH2=C(CH3)COOH![]() CH2=C(CH3)COOCH2CH2OH+H2O。
CH2=C(CH3)COOCH2CH2OH+H2O。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】“烂版液”是制印刷锌版时,用稀硝酸腐蚀锌版后得到的“废液”(含有少量的Cl-、Fe3+)。某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是______(填化学式,下同)。
(2)沉淀Ⅰ的主要成分是____________。
(3)操作③中加热煮沸的目的是_____________;此步操作的理论依据是_______________。
(4)操作④保持pH=2的目的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH=+169.8 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(2)Na2S的水溶液洗患处可以用来治疗由一种小芥虫在皮肤内生活引起的皮肤病,而且用热水配制的Na2S溶液治疗效果更好。请说明原因 ,并写出有关的化学方程式 。
(3)某自来水中含有Ca2+、Mg2+、Na+、K+、HCO、SO、Cl-,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。
已知部分物质20 ℃时的溶解度数据:
物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
溶解度/(g/100 g H2O) | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.1×10-1 | 26.7 |
①请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:______________________。
②锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去。试剂X是________(填序号)。
A.食醋 B.氯化钡 C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述) _______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究有机物一般经过以下几个基本步骤:分离、提纯 → 确定实验式 → 确定分子式 → 确定结构式。有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的相对分子质量为 。 |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为 。 |
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团 |
(4)A的核磁共振氢谱如下图:
| (4)A中含有 种氢原子。 综上所述,A的结构简式为 。 |
(5)两分子A可反应生成一个六元环状化合物 | (5)写出此反应的方程式 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。

(2)己知下列热化学方程式:

由此可知反应:![]() 的焓变为 。
的焓变为 。
(3)在一固定体积的密闭容器中,进行如下化学反应
![]() 其化学平衡常数K与t的关系如下表:
其化学平衡常数K与t的关系如下表:

请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填写字母序号)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(正)(N2)=v(逆)(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改变
F.混合气体中各成分的浓度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g)![]() 2C1NO(g),
2C1NO(g),
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)![]() NaNO3(s)+ClNO(g)K1
NaNO3(s)+ClNO(g)K1
②4NO2(g)+2NaC1(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)K2
2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+C12(g)![]() 2C1NO(g)K3
2C1NO(g)K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):

则2NO(g)+C12(g)![]() 2C1NO(g)反应的△H和a的关系为△H=______________kJ/mol。
2C1NO(g)反应的△H和a的关系为△H=______________kJ/mol。
(3)300℃时.2NO(g)+C12(g)![]() 2ClNO(g)的正反应速率表达式为v正=k·cn(ClNO),
2ClNO(g)的正反应速率表达式为v正=k·cn(ClNO),
测得速率和浓度的关系如下表:

n=____________;k=____________(注明单位)。
(4)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:

①该反应的△H____________0(填“>”“<”或“=”)。
②反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min),
③T2时该反应的平衡常数K=____________
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是____________点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
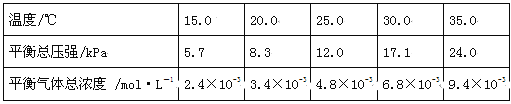
①可以判断该分解反应已经达到平衡的是 。(填编号)
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数: 。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量 (填“增加”,“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH 0(填“>”、“=”或“<”),熵变ΔS 0(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2![]() NH4HCO3+NH3·H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
NH4HCO3+NH3·H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。

计算25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
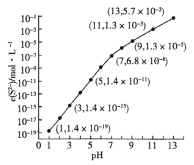
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如下表。

①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型无机非金属材料中,氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:

请回答下列问题:
(1) 由B2O3制备BN的化学方程式是_________________________________;
(2) 基态B原子的电子排布图为________________;B和N相比,电负性较大的是__________,BN中B元素的化合价为__________;
(3) 在BF3分子中,F—B—F的键角是________, B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF-4的立体构型为________;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___________________,层间作用力为________;
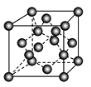
(5) 六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm,立方氮化硼的一个晶胞中含有______个氮原子、________个硼原子,立方氮化硼的密度是________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA,右图为金刚石晶胞)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com